
题目列表(包括答案和解析)


| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时约pH | |
| Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
(14分)氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,在将滤液按下图所示步骤进行操作。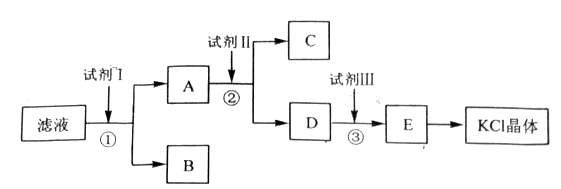
回答下列问题:
(1)起始滤液的pH_____________7(填“大于”、“小于”或“等于”)原因是________________________________________。
(2)试剂I的化学式为______________________,①中发生反应的离子方程式为_________________________________________。
(3)试剂Ⅱ的化学式为______________________,②中加入试剂Ⅱ的目的是______________________________________;
(4)试剂Ⅲ的名称是______________________,③中发生反应的离子方程式为______________________________________;
(5)某同学称取提纯的产品0.7759g,溶解后定定容在100mL容量瓶中,每次取25.00mL溶液,用0.1000mol·L-1的硝酸银标准溶液滴定,三次滴定消耗标准溶液的平均体积为25.62mL,该产品的纯度为 。
(14分)氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,在将滤液按下图所示步骤进行操作。

回答下列问题:
(1)起始滤液的pH_____________7(填“大于”、“小于”或“等于”)原因是________________________________________。
(2)试剂I的化学式为______________________,①中发生反应的离子方程式为_________________________________________。
(3)试剂Ⅱ的化学式为______________________,②中加入试剂Ⅱ的目的是______________________________________;
(4)试剂Ⅲ的名称是______________________,③中发生反应的离子方程式为______________________________________;
(5)某同学称取提纯的产品0.7759g,溶解后定定容在100mL容量瓶中,每次取25.00mL溶液,用0.1000mol·L-1的硝酸银标准溶液滴定,三次滴定消耗标准溶液的平均体积为25.62mL,该产品的纯度为 。
现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按下图所示步骤进行提纯:
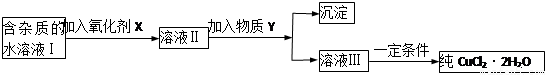

已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,要将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、6.4、3.7。
请回答下列问题 [(1)~(2)小题填标号] :
(1)本实验最适合的氧化剂X是__________
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)物质Y不可以是___________
A.CuO B.CuCl2 C.Cu(OH)2 D.CuCO3
(3)若Y为Cu(OH)2,写出除去Fe3+的离子方程式:
(4)加入氧化剂的目的是_______________________________________。
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O?__________(填“能”或“不能”)。如不能,应如何操作?(如能,此空不填)_______________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com