
题目列表(包括答案和解析)
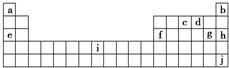
 下表是元素周期表的一部分,表中所列字母分别代表十种化学元素,就表中字母所代表的元素回答下列问题.
下表是元素周期表的一部分,表中所列字母分别代表十种化学元素,就表中字母所代表的元素回答下列问题.

| ||
| ||
(1)①铅位于元素周期表中第_________周期第_________族;
②PbO2是一种两性氧化物,试写出PbO2和NaOH浓溶液反应的离子方程式:________________________________;
③铅蓄电池是目前最普及的一种蓄电池。它是以Pb、PbO2为电极,以H2SO4溶液为电解液。由于硫酸浓度较大,实际参加反应的是![]() ,而不是
,而不是![]() 。铅蓄电池放电时负极反应和电池总反应分别为:
。铅蓄电池放电时负极反应和电池总反应分别为:
反极反应式
Pb+![]() -2e-====PbSO4+H+
-2e-====PbSO4+H+
电池总反应式
Pb+PbO2+2H2SO4====2PbSO4+2H2O
则铅蓄电池放电时正极反应式为:____________________________________________。
(2)在真空密闭容器中加入一定量的PH4I固体,在一定温度下发生反应:
PH4I(s)![]() PH3(g)+HI(g),4PH3(g)
PH3(g)+HI(g),4PH3(g) ![]() P4(g)+6H2(g),2HI(g)
P4(g)+6H2(g),2HI(g) ![]() H2(g)+I2(g)平衡后,增大压强,溶器内n(PH4I)____________(填“增加”“减少”或“不变”,下同),n(I2) ____________。
H2(g)+I2(g)平衡后,增大压强,溶器内n(PH4I)____________(填“增加”“减少”或“不变”,下同),n(I2) ____________。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com