
题目列表(包括答案和解析)
(8分)从短周期元素中找出满足下列条件的单质或化合物:
⑴跟水反应最剧烈的金属元素的单质是 ;跟水反应最剧烈的非金属元素的单质是 ;常温下有颜色的气体单质是 。
⑵含氢质量分数最大的气态氢化物是 ;水溶液对玻璃有强烈腐蚀性的气态氢化物是 ;四核10电子粒子有 。
(本题共8分)将2molCO2和6molH2充入容积为3L的密闭容器中,在一定温度和压强条件下发生了下列反应:CO2(g)+3H2
(g) CH3OH(g)+H2O(g)
+49.0 kJ。反应在2分钟时达到了平衡。
CH3OH(g)+H2O(g)
+49.0 kJ。反应在2分钟时达到了平衡。
(1).用H2与CO2浓度的变化表示该反应的速率,以它们的速率表示反应达到平衡的关系式是_____________________。
(2).当改变反应的某一个条件,平衡一定向正反应方向移动的是__________。
a.逆反应速率先增大后减少 b.正反应速率先增大后减少
c.某反应物的体积百分含量减小 d.化学平衡常数K值增大
(3).达到平衡时,改变温度(T)和压强(P),反应混合物中CH3OH的“物质的量分数”变化情况如图所示,关于温度(T)和压强(P)的关系判断正确的是 (填序号)。

A.P3>P2 T3>T2 B.P2>P4 T4>T2
C.P1>P3 T1>T3 D.P1>P4 T2>T3
(4).平衡时,测得H2O(g)的物质的量分数为0.30,则用H2O(g)的物质的量浓度变化来表示该反应在2分钟内的平均反应速率为 mol ∙ L-1∙ min-1。
(8分)钢铁很容易生锈而被腐蚀。
(1)钢铁腐蚀主要是吸氧腐蚀,吸氧腐蚀过程中的电极反应为:
负极_______________ _______________;
正极_______________________________ 。
(2)为了降低某水库的铁闸门的腐蚀速率,可以采用图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用 _________(填序号)。

A.铜 B.钠 C.锌 D.石墨
(3)图乙所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的___________极上。
(8分)经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
(1)定性分析:如图甲可通过观察___________________________________定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是____________________,
写出H2O2在二氧化锰作用下发生反应的化学方程式:
_____________________________________________________。
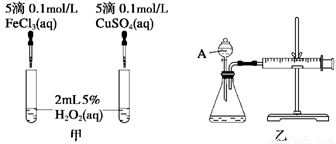
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为________,实验中需要测量的数据是_________________。
(8分,每空2分)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)写出与H2O分子互为等电子体的微粒___ ___(填1种)。
(2)水分子在特定条件下容易得到一个H+,形成水合氢原子(H3O+)。下列对上述过程的描述不合理的是 ( )
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
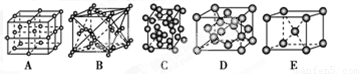
(3)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是________(请用相应的编号填写)。
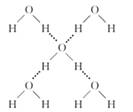
(4)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如下图所示),已知冰的升华热是51 kg/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_____ ___kJ/mol;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com