CoCl
2?6H
2O是一种饲料营养强化剂.一种利用水钴矿[主要成分为Co
2O
3、Co(OH)
3,还含少量Fe
2O
3、Al
2O
3、MnO等]制取CoCl
2?6H
2O的工艺流程如下:
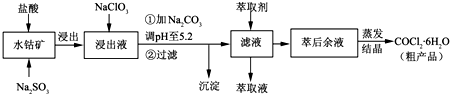
已知:①浸出液含有的阳离子主要有H
+、Co
2+、Fe
2+、Mn
2+、Al
3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
7.6 |
7.6 |
4.0 |
7.7 |
| 完全沉淀 |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
(1)写出浸出过程中Co
2O
3发生反应的离子方程式
Co2O3+SO32-+4H+=2Co2++SO42-+2H2O
Co2O3+SO32-+4H+=2Co2++SO42-+2H2O
.
(2)NaClO
3的作用是
将Fe2+氧化成Fe3+
将Fe2+氧化成Fe3+
.
(3)加Na
2CO
3调pH至5.2所得沉淀为
Fe(OH)3、Al(OH)3
Fe(OH)3、Al(OH)3
.
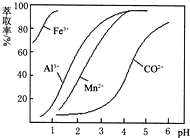
(4)萃取剂对金属离子的萃取率与pH的关系如右图.萃取剂的作用是
除去溶液中的Mn2+
除去溶液中的Mn2+
;其使用的适宜pH范围是
B
B
.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(5)为测定粗产品中CoCl
2?6H
2O含量,称取一定质量的粗产品溶于水,加入足量AgNO
3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl
2?6H
2O的质量分数大于100%,其原因可能是
粗产品含有可溶性氯化物或晶体失去了部分结晶水
粗产品含有可溶性氯化物或晶体失去了部分结晶水
.(答一条即可)




