
题目列表(包括答案和解析)
正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。

发生的反应如下:
CH3CH2CH2CH2OH CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 |
正丁醇 | 117.2 | 0.810 9 | 微溶 |
正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:
将6.0 g Na2 Cr2O7放入100 mL烧杯中,加30 mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分。
将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0 g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由______________________。
(2)加入沸石的作用是________。若加热后发现未加沸石,应采取的正确方法是________。
(3)上述装置图中,B仪器的名称是________,D仪器的名称是________。
(4)分液漏斗使用前必须进行的操作是________(填正确答案标号)。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分离水时,水在________层(填“上”或“下”)。
(6)反应温度应保持在90~95℃,其原因是__________________________________。
实验室配制80 mL 0.1 mol/L的FeSO4溶液,请回答以下问题.
(1)请画出实验用到的最主要的仪器.
(2)实验中用托盘天平称量的绿矾(FeSO4·7H2O)的质量为________.
(3)定容的操作是________.
(4)分析以下操作对配制的溶液浓度造成的影响(填“偏高”、“无影响”、“偏低”)
①蒸馏水洗完容量瓶后没有烘干________
②转移溶液过程中出现漏液________
③未用蒸馏水洗涤烧杯________
④定容时俯视(视线偏高)________
⑤摇匀后发现液面降低,再加蒸馏水________
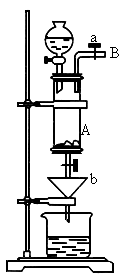
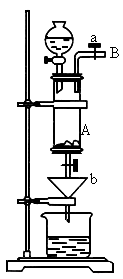
三氯化铁是中学化学实验室中不可缺少的重要试剂.某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备![]() ,该同学设计的实验装置如图所示,A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a、关闭b,从分液漏,斗内向A中滴加过量盐酸,此时溶液显浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿中加热,蒸发掉部分水并除去多余的
,该同学设计的实验装置如图所示,A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a、关闭b,从分液漏,斗内向A中滴加过量盐酸,此时溶液显浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿中加热,蒸发掉部分水并除去多余的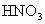 ,再降温结晶得
,再降温结晶得![]() 晶体,填写下列空白:
晶体,填写下列空白:
(1)滴加盐酸时,发现反应速率比盐酸与纯铁粉的反应快,其原因是______
_____________________________________________________________。
(2)烧杯中稀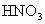 的作用是(用离子方程式表示)____________________
的作用是(用离子方程式表示)____________________
_____________________________________________________________。
(3)整个实验过程中,弹簧夹a必须始终打开,其目的是_______________.
(4)若不用降温结晶的方法制取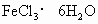 ,而是直接将溶液加热至无气体放出,最终得到的固体是_____________(写化学式).
,而是直接将溶液加热至无气体放出,最终得到的固体是_____________(写化学式).
三氯化铁是中学化学实验室中不可缺少的重要试剂.某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备![]() ,该同学设计的实验装置如图所示,A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a、关闭b,从分液漏,斗内向A中滴加过量盐酸,此时溶液显浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿中加热,蒸发掉部分水并除去多余的
,该同学设计的实验装置如图所示,A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a、关闭b,从分液漏,斗内向A中滴加过量盐酸,此时溶液显浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿中加热,蒸发掉部分水并除去多余的 ,再降温结晶得
,再降温结晶得![]() 晶体,填写下列空白:
晶体,填写下列空白:
(1)滴加盐酸时,发现反应速率比盐酸与纯铁粉的反应快,其原因是______
_____________________________________________________________。
(2)烧杯中稀 的作用是(用离子方程式表示)____________________
的作用是(用离子方程式表示)____________________
_____________________________________________________________。
(3)整个实验过程中,弹簧夹a必须始终打开,其目的是_______________.
(4)若不用降温结晶的方法制取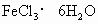 ,而是直接将溶液加热至无气体放出,最终得到的固体是_____________(写化学式).
,而是直接将溶液加热至无气体放出,最终得到的固体是_____________(写化学式).
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com