
题目列表(包括答案和解析)
 (2013?河西区一模)肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.请按要求回答下列问题:
(2013?河西区一模)肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.请按要求回答下列问题:

| ||
| ||
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
| n(NH3) |
| n(CO2) |
| n(N2) | n(H2) | n(NH3) | |
| 甲 | 1mol | 3mol | 0mol |
| 乙 | 0.5mol | 1.5mol | 1mol |
| 丙 | 0mol | 0mol | 4mol |
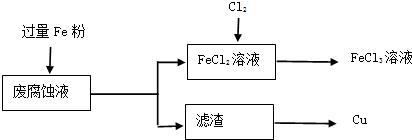
| 通电 |
| 加热 |
 H2+I2Ⅲ.2H2SO4=2SO2+O2+2H2O
H2+I2Ⅲ.2H2SO4=2SO2+O2+2H2O CH3OH(g)分析该反应并回答下列问题:
CH3OH(g)分析该反应并回答下列问题: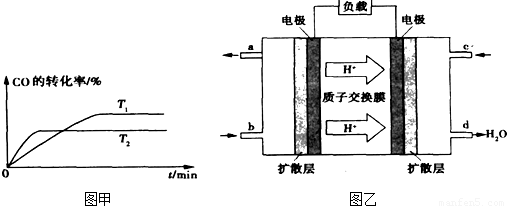
甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。
(1)工业生产甲醇的常用方法是:CO(g)+2H2(g) ![]() CH3OH(g) △H = —90.8kJ/mol。
CH3OH(g) △H = —90.8kJ/mol。
已知:2H2(g)+O2(g)=2H2O(l) △H =![]() —571.6kJ/mol;
—571.6kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H = —566.0kJ/mol
①计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H = ▲ 。
②若在恒温恒容的容器![]() 内进行反应CO(g)+2H2(g)
内进行反应CO(g)+2H2(g) ![]() CH3OH(g),下列表示该反应达到平衡状态的标志有 ▲ (填字母序号)。
CH3OH(g),下列表示该反应达到平衡状态的标志有 ▲ (填字母序号)。
A.容器中混合气体的密度不变化 B.CO百分含量保持不变
C.容器中混合气体的压强不变化 D.有1个H—H键生成的同时有 3个C—H键生成
(2)制甲醇所需要的H2,可用下列反应制取:H2O(g)+CO(g) ![]() H2(g)+ CO2(g) △H<0,某温度下该反应的平衡常数K = 1。若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,试回答下列问题:
H2(g)+ CO2(g) △H<0,某温度下该反应的平衡常数K = 1。若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,试回答下列问题:
①该温度下,反应进行一阶段时间后,测得H2的浓度为0.5mol•L-1,则此时该反应
 v(正) ▲ v(逆)(填“>”、“<”或“=”);
v(正) ▲ v(逆)(填“>”、“<”或“=”);
 ②若反应温度不变,达到平衡后,H2O的转化率为 ▲ 。
②若反应温度不变,达到平衡后,H2O的转化率为 ▲ 。
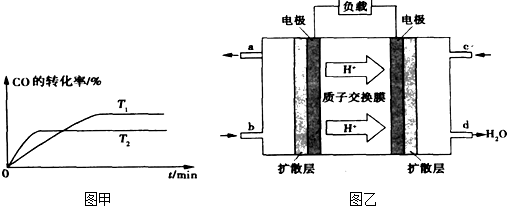
(3)某实验小组设计了如右图所示的甲醇燃料电池装置。
①该电池工作时,OH— 向 ▲ 极移动(填“a”或“b”);
②工作一段时间后,测得溶液的pH减小,该电池
负极反应的离子方程式为 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com