
题目列表(包括答案和解析)
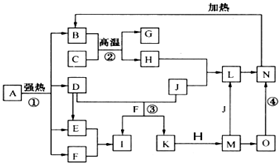 仔细阅读图,已知B、D、E、F、G是氧化物,其中D是形成酸雨的主要污染物,F、K是氢化物,且F在常温下为液态;C、H是日常生活中最为常见的金属单质,J是气态非金属单质,O是白色沉淀,且B、H、L、M、N、O中含有同种元素(图中部分反应物或产物已略去)请按要求回答:
仔细阅读图,已知B、D、E、F、G是氧化物,其中D是形成酸雨的主要污染物,F、K是氢化物,且F在常温下为液态;C、H是日常生活中最为常见的金属单质,J是气态非金属单质,O是白色沉淀,且B、H、L、M、N、O中含有同种元素(图中部分反应物或产物已略去)请按要求回答:
| ||
. |
| ||
. |
(14分)下图表示有关物质之间的转化关系,其中A、B均为无色盐溶液,B的焰色反应呈黄色,F是形成酸雨的污染物之一,H难溶于水且不溶于稀盐酸。(部分产物略去)
(1)A、B、E、F代表的物质分别为 、 、 、 (填化学式);
(2)反应①的离子反应方程式为 ;
(3)若E与F的物质的量之比为n(E) : n(F)>1:1,则在混合溶液G中滴入几滴石蕊
: n(F)>1:1,则在混合溶液G中滴入几滴石蕊
试液,可观察到的现象为 ;
(4)若E与F的物质的量之比1:1,则③中发生的离子反应方程式为
;
(5)④中发生的反应离子方程式为 。
(14分)X、Y、Z、W、G、和H均由短周期元素组成,它们是中学化学中常见的气体,具有如下性质:
①X、Y、G能使湿润的蓝色石蕊试纸变红,H能使湿润的红色石蕊试纸变蓝,Z、W不能使湿润的石蕊试纸变色;
②X和H相遇产生白烟;
③Y是形成酸雨的主要气体且能使品红溶液褪色;
④Z和W相遇生成红棕色气体;
⑤G在W中燃烧可以产生Y和H2O;
⑥回答下列问题:
(1) H的化学式是__________,
实验室制取H的化学反应方程式是___________________________________________;
(2)Z的化学式是________,W的化学式是__________________;
(3)⑤中发生反应的化学方程式是___________________________________________;
(4)实验室制备、收集干燥的Y气体,所需仪器如下。装置A产生Y气体 ,按气流方向连接各仪器接口,顺序为a
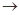
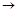 f:
f:
装置D的作用是_ ___,装置E中NaOH溶液的作用是__ ____。
仔细阅读下图,已知B、D、E、F、G是氧化物,其中D是形成酸雨的主要污染物,F、K是氢化物,且F在常温下为液态;C、H是日常生活中最为常见的金属单质,J是气态非金属单质,O是白色沉淀,且B、H、L、M、N、O中含有同种元素(图中部分反应物或产物已略去)。请按要求回答:
(1)反应①既是分解反应,又是氧化还原反应,产物B、D、E、F的物质的量之比1:1:1:14。A强热分解的化学反应方程式为 ▲ 。
(2)写出反应②在工业生产上的一种用途: ▲ 。
(3)反应③的离子方程式为 ▲ ;
反应④的化学方程式为 ▲ 。
表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅧA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | ⑦ | | ⑧ | ⑨ | |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com