液氯储罐中常混有NCl
3,当液氯中NCl
3的质量分数达到4%以上就有爆炸危险.
(1)NCl
3易水解生成一种碱性气体和一种具有漂白性的物质.写出该反应的化学方程式
.
(2)为测定氯气中的NCl
3含量,将一定量样品先通过足量盐酸吸收NCl
3(反应为:NCl
3+4HCl→NH
4Cl+3Cl
2),再用400mL 20.0%(ρ=1.22g/cm
3)的工业NaOH溶液吸收所有的Cl
2,测得吸收后NaOH溶液增重51.4g.经测定NCl
3吸收管内NH
4+质量为0.270g.
①上述工业NaOH溶液的物质的量浓度为
.
②计算该样品中NCl
3的质量分数,并判断该样品是否安全?
(3)一般情况下,较强的氧化剂如:MnO
2、KMnO
4、KClO
3、Ca(ClO)
2等氧化浓盐酸时,有如下反应规律:氧化剂+浓盐酸→金属氯化物+水+氯气.实验室通常用该原理制取少量Cl
2.
①将214.5g Ca(ClO)
2放入500mL 12.0mol/L的浓盐酸中,生成的Cl
2在标准状况下的体积为39.2L.若反应前后溶液的体积保持不变,计算反应后溶液中HCl的物质的量浓度.
②漂白粉是 Ca(ClO)
2、CaCl
2、Ca(OH)
2、H
2O和CaO的混合物.漂白粉放出的氯气具有漂白作用,叫有效氯.通常用有效氯表示漂白粉的纯度.漂白粉中的有效氯含量常用滴定碘法进行测定,即在一定量的漂白粉中加入过量的KI,加H
2SO
4酸化,有效氯与I
-作用析出等量的I
2,析出的I
2以淀粉指示剂立即用Na
2S
2O
3标准溶液滴定.若测定漂白粉中有效氯时用盐酸酸化,则盐酸的浓度应小于
mol/L,否则测定的有效氯将
(选填“偏高”、“偏低”或“不变”).

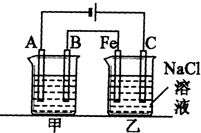
 如图为相互串联的甲乙两个电解池,请回答:
如图为相互串联的甲乙两个电解池,请回答: 如图为相互串联的甲乙两个电解池,请回答:
如图为相互串联的甲乙两个电解池,请回答: 如图所示:甲、乙为相互串联的两电解池.试回答:
如图所示:甲、乙为相互串联的两电解池.试回答: