
题目列表(包括答案和解析)
下列方程式正确的是
A.热化学方程式C2H2(g)+5/2O2(g)= 2CO2(g)+H2O(g)△H = -1256kJ/mol ,表示乙炔的燃烧热为1256 kJ/mol
B.高锰酸钾酸性溶液与草酸溶液反应:2MnO4-+ 5C2O42- + 16H+ = 2Mn2+ + 10CO2↑+ 8H2O
C.在稀氨水中通入少量CO2:2NH3·H2O+CO2=2NH+CO2+H2O
D.用银氨溶液检验乙醛中的醛基:
CH3CHO+2[Ag(NH3)2]++2OH-  CH3COO-+NH4++3NH3+2Ag↓+H2O
CH3COO-+NH4++3NH3+2Ag↓+H2O
在化学分析中,为了测定某试样中FeSO4·7H2O的质量分数,一般采用在酸性条件下用高锰酸钾标准溶液滴定的方法,反应原理为:5Fe2++8H++MnO4-![]() 5Fe3++Mn2++4H2O。高锰酸钾标准溶液可用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]进行标定,反应原理为:5C2O42-+2MnO4-+16H+
5Fe3++Mn2++4H2O。高锰酸钾标准溶液可用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]进行标定,反应原理为:5C2O42-+2MnO4-+16H+![]() 10CO2↑+2Mn2++8H2O。
10CO2↑+2Mn2++8H2O。
实验步骤如下:
步骤一:先粗配浓度约为1.5×10-2mol·L-1的高锰酸钾溶液500 mL。
步骤二:称取Na2C2O4固体m g放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70~80℃,用(1)所配高锰酸钾溶液进行滴定,从而可标定高锰酸钾溶液的浓度。经测定,c(KMnO4)=0.0160 mol·L-1
步骤三:称取FeSO4·7H2O试样1.073g,放入锥形瓶中,加入适量的水溶解,
步骤四:用标准高锰酸钾溶液滴定步骤三所配样品溶液,达到终点时消耗标准溶液48.00mL。
试回答下列问题:
(1)步骤一中要用到的玻璃仪器是烧杯、___________ 、 。
(2)步骤二中需要对m的大致值进行预估,你预估的依据是
___________________________________________________ 。
(3)本实验中操作滴定管的以下图示,正确的是______________(填编号)。

(4)步骤二的滴定是在一定温度下进行的,操作过程中发现前一阶段溶液褪色较慢,中间阶段褪色明显变快,最后阶段褪色又变慢。试根据影响化学反应速率的条件分析,溶液褪色明显变快的原因可能是 ______________________ 。
(5)请在下面空白处设计步骤四中的数据记录和数据处理表格(不必填数据)。
(6)国家标准规定FeSO4·7H2O的含量(w):一级品100.5%≥w≥99.50%;二级品 100.5%≥w ≥99.00%;三级品 101.0%≥w≥98.00%。试判断该试样符合国家________级品标准。
(7)测定试样中FeSO4·7H2O的含量时,有时测定值会超过100%,其原因可能是
_______________________________________________ 。
 5Fe3++Mn2++4H2O。高锰酸钾标准溶液可用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]进行标定,反应原理为:5C2O42-+2MnO4-+16H+
5Fe3++Mn2++4H2O。高锰酸钾标准溶液可用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]进行标定,反应原理为:5C2O42-+2MnO4-+16H+ 10CO2↑+2Mn2++8H2O。
10CO2↑+2Mn2++8H2O。
在化学分析中,为了测定某试样中FeSO4?7H2O的质量分数,一般采用在酸性条件下用高锰酸钾标准溶液滴定的方法,反应原理为:5Fe2++8H++MnO4-=5Fe3++Mn2++4H2O。高锰酸钾标准溶液可用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]进行标定,反应原理为:
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O。
实验步骤如下:
步骤一:先粗配浓度约为1.5×10-2mol?L-1的高锰酸钾溶液500 mL。
步骤二:称取Na2C2O4固体m g放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70~80℃,用步骤一所配高锰酸钾溶液进行滴定,从而可标定高锰酸钾溶液的浓度。经标定,c(KMnO4)=1.6×10―2mol/L
步骤三:称取FeSO4?7H2O试样1.073g,放入锥形瓶中,加入适量的水溶解。
步骤四:用标准高锰酸钾溶液滴定步骤三所配样品溶液,达到终点时消耗标准溶液48.00mL。
试回答下列问题:
(1)步骤一中要用到的玻璃仪器是烧杯、___________ 、 。
(2)步骤二中需要对m的大致值进行预估,你预估的依据是
_______________________________________________ 。
(3)本实验中操作滴定管的以下图示,正确的是______________(填编号)。

(4)步骤二的滴定是在一定温度下进行的,操作过程中发现前一阶段溶液褪色较慢,中间阶段褪色明显变快,最后阶段褪色又变慢。试根据影响化学反应速率的条件分析,溶液褪色明显变快的原因可能是_________ 。
(5)请在下面空白处设计步骤四中的数据记录和数据处理表格(不必填数据)。
(6)国家标准规定FeSO4?7H2O的含量(w):一级品100.5%≥w≥99.50%;二级品100.5%≥w ≥99.00%;三级品 101.0%≥w≥98.00%。试判断该试样符合国家________级品标准。
(7)测定试样中FeSO4?7H2O的含量时,有时测定值会超过100%,其原因可能是 ________________________________________ 。
在化学分析中,为了测定某试样中FeSO4·7H2O的质量分数,一般采用在酸性条件下用高锰酸钾标准溶液滴定的方法,反应原理为:5Fe2++8H++MnO4-![]() 5Fe3++Mn2++4H2O.高锰酸钾标准溶液可用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]进行标定,反应原理为:5C2O42-+2MnO4-+16H+
5Fe3++Mn2++4H2O.高锰酸钾标准溶液可用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]进行标定,反应原理为:5C2O42-+2MnO4-+16H+![]() 10CO2↑+2Mn2++8H2O.
10CO2↑+2Mn2++8H2O.
实验步骤如下:
步骤一:先粗配浓度约为1.5×10-2 mol·L-1的高锰酸钾溶液500 mL.
步骤二:称取Na2C2O4固体m g放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70~80℃,用(1)所配高锰酸钾溶液进行滴定,从而可标定高锰酸钾溶液的浓度.经测定,c(KMnO4)=0.0160 mol·L-1
步骤三:称取FeSO4·7H2O试样1.073 g,放入锥形瓶中,加入适量的水溶解,
步骤四:用标准高锰酸钾溶液滴定步骤三所配样品溶液,达到终点时消耗标准溶液48.00 mL.
试回答下列问题:
(1)步骤一中要用到的玻璃仪器是烧杯、________、________.
(2)步骤二中需要对m的大致值进行预估,你预估的依据是_______________________.
(3)本实验中操作滴定管的以下图示,正确的是________(填编号).
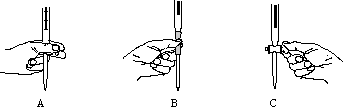
(4)步骤二的滴定是在一定温度下进行的,操作过程中发现前一阶段溶液褪色较慢,中间阶段褪色明显变快,最后阶段褪色又变慢.试根据影响化学反应速率的条件分析,溶液褪色明显变快的原因可能是_________________________.
(5)请在下面设计步骤四中的数据记录和数据处理表格(不必填数据).
(6)国家标准规定FeSO4·7H2O的含量(w):一级品100.5%≥w≥99.50%;二级品100.5%≥w≥99.00%;三级品101.0%≥w≥98.00%.试判断该试样符合国家________级品标准.
(7)测定试样中FeSO4·7H2O的含量时,有时测定值会超过100%,其原因可能是____________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com