
题目列表(包括答案和解析)
牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡:
![]()
(1)进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到损失,其原因是________.
(2)已知Ca5(PO4)3F(s)的溶解度比上面的矿化产物更小,质地坚固,请用离子方程式表示,当牙膏中配有氟化物添加剂后能防止龋齿的原因________.
(3)根据以上原理,请你提供一种其他促进矿化的方法________.解析:本题考查的内容主要是电离平衡的移动和离子方程式的书写.
(1)c(OH-)减小,则平衡向脱矿方向移动.
(2)牙膏中的氟化物电离出F-,与Ca2+、PO![]() 结合成Ca5(PO4)3F更难电离.
结合成Ca5(PO4)3F更难电离.
(3)欲使平衡向矿化方向移动,应该增大c(Ca2+)或c(PO![]() ),而不宜大幅度增大c(OH-).
),而不宜大幅度增大c(OH-).
(13分)某学生为测定未知浓度的硫酸溶液,实验如下:用I.00mL待测硫酸配制100mL稀H2S04溶液;以0.14mol/L的NaOH溶液滴定上述稀H2S04 25mL,滴定终止时消耗NaOH溶液15mL。
(1)该学生用标准o.14mol/L的NaOH溶液滴定硫酸的实验操作如下:
A、用酸式滴定管取稀H2S04 25mL,注入锥形瓶中,加入指示剂;
B、用待测定的溶液润洗酸式滴定管;
C、用蒸馏水洗干净滴定管;
D、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上1~2cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下;
E、检查滴定管是否漏水;
F、另取锥形瓶,再重复操作一次;
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是 (用序号填写)
②该滴定操作中应选用的指示剂是 。
③在G操作中如何确定终点? 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果 (填“偏小”“偏大”或“恰好合适”),原因是 。
(3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度为 mol/L(结果保留两位小数点)。
【解析】考查中和滴定实验操作及误差分析。滴定管在使用前需要查漏,然后用蒸馏水洗涤,最后用标准液润洗。硫酸和氢氧化钠恰好反应时,溶液显中性,所以应选择酚酞作指示剂。当反应达到滴定终点时,溶液将变成红色。若碱式滴定管未用标准液润洗,则相当于稀释了氢氧化钠溶液,从而导致消耗氢氧化钠溶液的体积偏大,测定结果偏大。根据题意可知消耗氢氧化钠的物质的量是0.14mol/L×0.015L=0.0021mol,所以需要硫酸的物质的量是0.00105mol,因此硫酸的浓度是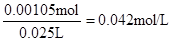 ,所以稀释前硫酸的浓度为0.042mol/L×100=4.2mol/L。
,所以稀释前硫酸的浓度为0.042mol/L×100=4.2mol/L。
(13分)某学生为测定未知浓度的硫酸溶液,实验如下:用I.00mL待测硫酸配制100mL稀H2S04溶液;以0.14mol/L的NaOH溶液滴定上述稀H2S04 25mL,滴定终止时消耗NaOH溶液15mL。
(1)该学生用标准o.14mol/L的NaOH溶液滴定硫酸的实验操作如下:
A、用酸式滴定管取稀H2S0425mL,注入锥形瓶中,加入指示剂;
B、用待测定的溶液润洗酸式滴定管;
C、用蒸馏水洗干净滴定管;
D、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上1~2cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下;
E、检查滴定管是否漏水;
F、另取锥形瓶,再重复操作一次;
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是 (用序号填写)
②该滴定操作中应选用的指示剂是 。
③在G操作中如何确定终点? 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果 (填“偏小”“偏大”或“恰好合适”),原因是 。
(3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度为 mol/L(结果保留两位小数点)。
【解析】考查中和滴定实验操作及误差分析。滴定管在使用前需要查漏,然后用蒸馏水洗涤,最后用标准液润洗。硫酸和氢氧化钠恰好反应时,溶液显中性,所以应选择酚酞作指示剂。当反应达到滴定终点时,溶液将变成红色。若碱式滴定管未用标准液润洗,则相当于稀释了氢氧化钠溶液,从而导致消耗氢氧化钠溶液的体积偏大,测定结果偏大。根据题意可知消耗氢氧化钠的物质的量是0.14mol/L×0.015L=0.0021mol,所以需要硫酸的物质的量是0.00105mol,因此硫酸的浓度是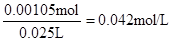 ,所以稀释前硫酸的浓度为0.042mol/L×100=4.2mol/L。
,所以稀释前硫酸的浓度为0.042mol/L×100=4.2mol/L。
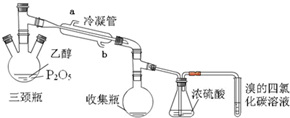 有学生用五氧化二磷作为乙醇脱水制乙烯的催化剂,进行相关实验.按表所示的量和反应条件在三颈瓶中加入一定量P2O5,并注入95%的乙醇,并加热,观察现象.
有学生用五氧化二磷作为乙醇脱水制乙烯的催化剂,进行相关实验.按表所示的量和反应条件在三颈瓶中加入一定量P2O5,并注入95%的乙醇,并加热,观察现象.| 实验 | P2O5/g | 95%乙醇量/mL | 加热方式 |
| 实验1 | 2 | 4 | 酒精灯 |
| 实验2 | 2 | 4 | 水浴70℃ |
| 实验 | 实验现象 | ||
| 三颈瓶 | 收集瓶 | 试管 | |
| 实验1 | 酒精加入时,立刻放出大量的白雾,开始有气泡产生,当用酒精灯加热时,气泡加快生成并沸腾,生成粘稠状液体. | 有无色液体 | 溶液褪色 |
| 实验2 | 酒精加入时,有少量白雾生成,当用水浴加热时,不产生气泡,反应一个小时,反应瓶内生成粘稠状液体 | 有无色液体 | 溶液不褪色 |
| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| 170℃ |
| ||
| ||
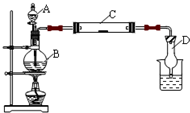 (2011?松江区模拟)为了制得氯气并探究氯气的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中.试回答:
(2011?松江区模拟)为了制得氯气并探究氯气的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中.试回答:
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com