
题目列表(包括答案和解析)
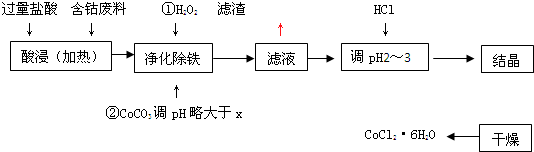
| 化学式 | 溶度积(室温时)Ksp | 沉淀完全时的pH | 氯化钴晶体的性质 |
| Co(OH)2 | 5.9×10-15 | 9.4 | CoCl2?6H2O呈红色,常温下稳定.110°C~120°C时脱水变成蓝色无水氯化钴 |
| Fe(OH)2 | 1.6×10-14 | 9.6 | |
| Fe(OH)3 | 1.0×10-35 | x |
计算题(共10分)
实验室常用的某盐酸试剂瓶的标签上的有关数据如下图,试根据标签上的
有关数据进行计算:
(1)计算该浓盐酸中HCl的
物质的量浓度。
(2)计算欲配制480ml 0.20mol/L的
稀盐酸溶液,需要取上述浓盐酸的体积。
(3)实验室用上述浓盐酸与二氧化锰
反应制取氯气,若制得0.56L
(标准状况)氯气,计算被氧化的 HCl的物质的量及转移电子的物质的量。
计算题(共10分)
实验室常用的某盐酸试剂瓶的标签上的有关数据如下图,试根据标签上的
有关数据进行计算:
(1)计算该浓盐酸中HCl的
物质的量浓度。
( 2)计算欲配制480ml 0.20mol/L的
2)计算欲配制480ml 0.20mol/L的
稀盐酸溶液,需要取上述浓盐酸的体积。
(3)实验室用上述浓盐酸与二氧化锰
反应制取氯气,若制得0.56L
(标准状况)氯气,计算被氧化的 HCl的物质的量及转移电子的物质的量。
(10分)计算填空:
(1)(2分)1mol某金属单质与足量的H2SO4反应,放出1.5molH2(标况下)并转化为具有Ne原子的电子层结构的离子,则该金属在周期表的位置 。
(2)(6 分)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:
_ aA (g)+ bB (g)  2C(g)
2C(g)
起始物质的量(mol): 3 2 0
2s末物质的量浓度(mol/L): 0.9 0.8 0.4
则①a= ,b= ;
②2S内B的反应速率= 。
(3)(2分) 1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com