
题目列表(包括答案和解析)
(04年上海卷)在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+ O2 (g) ![]() 2SO3(g) + Q (Q>0)
2SO3(g) + Q (Q>0)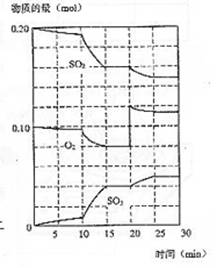
(1)写出该反应的化学平衡常数表达式
K=
(2)降低温度,该反应K值 ,
二氧化硫转化率 ,化学反应速度
(以上均填增大、减小或不变)
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混
合,反应过程中SO2、O2、SO3物质的量变化如图,
反应处于平衡状态的时间是 。
(4)据图判断,反应进行至20min时,曲线发生变化的
原因是 (用文字表达)
10min到15min的曲线变化的原因可能是 (填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
(04年北京卷)(18分)资料显示:“氨气可在纯氧中安静燃烧……”。某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。

(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是__________;碱石灰的作用是_______________________________。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
<1>氨催化氧化的化学方程式是___________________________________________;
试管内气体变为红棕色,该反应的化学方程式是_____________________________。
<2>停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中,试管内气体颜色变浅,请结合化学方程式说明原因_________________________________________
_____________________________________________________________________________
____________________________________________________________________________。
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:
<1>两气体通入的先后顺序是_______________________________________________,其理由是______________________________________________________________________
____________________________________________________________________________。
<2>氨气燃烧的化学方程式是_______________________________________________。
(04年江苏卷)(12分)有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。

请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:
 | |||
是否合理? 。请简要说明两点理由:
① ;② 。
(04年广东卷)(8分)
维生素C(又名抗坏血酸,分子式为C6H8O6)具有较强的还原性,放置在空气中易被氧化,其含量可通过在弱酸性溶液中用已知溶液的I2溶液进行滴定。该反应的化学方程式如下:

现欲测定某样品中维生素C的含量,具体的步骤及测得的数据如下。取10mL 6mol?L-1CH3COOH,加入100mL蒸馏水,将溶液加热煮沸后放置冷却。精确称取0.2000g样品,溶解于上述冷却的溶液中,加入1mL淀粉指示剂,立即用浓度为0.05000mol?L-1的I2溶液进行滴定,直至溶液中的蓝色持续不褪为止,共消耗21.00mLI2溶液。
(1)为何加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用?
(2)计算样品中维生素C的质量分数。
(04年北京卷)(15分)X、Y、Z为三个不同短周期非金属元素的单质。在一定条件下有如下反应:![]() (气),
(气),![]() (气)。请针对以下两种不同情况回答:
(气)。请针对以下两种不同情况回答:
(1)若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则:
<1>Y的化学式是_________;
<2>生成固体C的化学方程式是_______________________________________。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
<1>B的化学式是__________;
<2>向苛性钠溶液中通入过量的A,所发生反应的离子方程式是
_____________________________________________;
<3>将Y与(1)中某单质的水溶液充分反应可生成两种强酸,该反应的化学方程式是________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com