
题目列表(包括答案和解析)


| ||
| ||
金属铁用途广泛,高炉炼铁的总反应为:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g),请回答下列问题:
2Fe(s)+3CO2(g),请回答下列问题:
(1)一定温度下,在体积固定的密闭容器中发生上述反应,可以判断该反应已经达到平衡的是 。
A.密闭容器中总压强不变
B.密闭容器中混合气体的平均摩尔质量不变
C.密闭容器中混合气体的密度不变
D.c(CO)= c(CO2)
E.Fe2O3的质量不再变化
(2)一定温度下,上述反应的化学平衡常数为3.0,该温度下将4molCO、2molFe2O3、6molCO2、5molFe加入容积为2L的密闭容器中,此时反应将向 反应方向进行(填“正”或“逆”或“处于平衡状态”);反应达平衡后,若升高温度,CO与CO2的体积比增大,则正反应为 反应(填“吸热”或“放热”) 。
(3)已知:3Fe2O3(s)+CO(g) 2Fe3O4(s)+CO2(g) △H=–47
kJ/mol
2Fe3O4(s)+CO2(g) △H=–47
kJ/mol
Fe3O4(s)+CO(g) 3FeO(s)+CO2(g) △H=
+19 kJ/mol
3FeO(s)+CO2(g) △H=
+19 kJ/mol
FeO(s)+CO(g) Fe(s)+CO2(g) △H=–11 kJ/mol
Fe(s)+CO2(g) △H=–11 kJ/mol
则Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)的△H=
。
2Fe(s)+3CO2(g)的△H=
。
(4)上述总反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下表:
|
温度 |
250℃ ~ 600℃ ~ 1000℃ ~ 2000℃ |
|
主要成分 |
Fe2O3 Fe3O4 FeO Fe |
800℃时固体物质的主要成分为 ,该温度下若测得固体混合物中m(Fe)︰m(O)=105︰32,则Fe3O4被CO还原为FeO的百分率为 (设其它固体杂质中不含Fe、O元素)。
 2NO(g)+O2(g)在三种不同的条件下进行实验,其中实验I、Ⅱ都是在 800℃,实验Ⅲ是在850℃;NO、O2的起始浓度都为0,NO2 的起始浓度都为1.0 mol/L,NO2的浓度随时间的变化如图所示。请回答下列问题
2NO(g)+O2(g)在三种不同的条件下进行实验,其中实验I、Ⅱ都是在 800℃,实验Ⅲ是在850℃;NO、O2的起始浓度都为0,NO2 的起始浓度都为1.0 mol/L,NO2的浓度随时间的变化如图所示。请回答下列问题

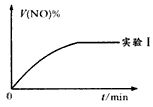
 NO(g)+O2(g)在三种不同的条件下进行实验,其中实验I、Ⅱ都是在800℃,实验Ⅲ是在850℃;NO、O2的起始浓度都为0,NO2的起始浓度都为1.0 mol/L,NO2的浓度随时间的变化关系如下图所示。请回答下列问题:
NO(g)+O2(g)在三种不同的条件下进行实验,其中实验I、Ⅱ都是在800℃,实验Ⅲ是在850℃;NO、O2的起始浓度都为0,NO2的起始浓度都为1.0 mol/L,NO2的浓度随时间的变化关系如下图所示。请回答下列问题: 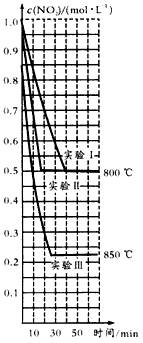
 n(NO)
n(NO) 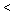 _________mol。
_________mol。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com