
题目列表(包括答案和解析)
某药学杂志报道合成了一种具有明显抗癌活性的药物,其结构如下图所示.J是其同分异构体,J的合成路线如下(部分产物略去):
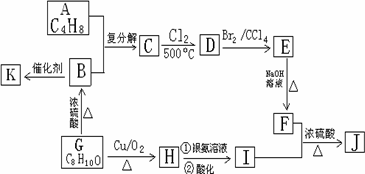
已知:①CH2=CHR1+CH2=CHR2![]() CH2=CH2+R1CH=CHR2
CH2=CH2+R1CH=CHR2
②R-CH2-CH=CH2+Cl2![]() R-CHCl-CH=CH2+HCl
R-CHCl-CH=CH2+HCl
③核磁共振氢谱图显示A分子中不同环境氢原子个数比为3∶1;F是油脂水解的产物之一,能与水按任意比互溶;K是一种高分子化合物.
请回答下列问题:
(1)请写出A和G的结构简式:A________;G________.
(2)请写出下列反应的反应类型:G→B:________;C→D:________.
(3)写出下列反应方程式:B→K:________;F+I→J:________.
(4)同时满足下列条件的I的同分异构体有________种,请写出其中任意一种结构简式:________
①分子中含有苯环结构;②能发生银镜反应;③苯环上的一氯代物有两种.
A-J分别代表中学化学中常见的一种单质或化合物,其转化关系如图.
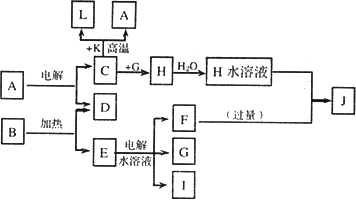
已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态;形成D的元素的原子最外层电子数是次外层的3倍;B在焰色反应中呈紫色(透过蓝色钴玻璃).
请回答:
(1)已知K为红棕色粉末,写出C与K反应的化学方程式________,引发该反应的操作为________.
(2)写出C与F反应的离子方程式________.
(3)若在上述转化关系中每一步反应均为恰好反应,且不考虑C+K→A+L的变化时,为了最终得到J,则A、B的物质的量之比为________.
下图所示反应I、反应II和反应III均是工业生产中常见的反应。其中A、B为化合物,C是温室气体之一,D和K均可用做干燥剂,H常温下为液态化合物,J是一种具有漂白作用的盐,反应III和E与G反应的原理相同。

(1)C与J的水溶液反应后生成的含氧酸的电子式是 。
(2)E与G反应的离子方程式是 。
(3)J久置后,即便不接触水、空气,本身也逐渐分解生成K,并放出气体,该反应的化学方程式是 。
(4)工业上测定反应III产品的有效成分J的含量,先将一定量的产品的溶液加入过量的KI溶液和稀硫酸中,使之反应生成I2,然后用Na2S2O3标准溶液滴定I2,计算出结果。
①用Na2S2O3标准溶液滴定I2时选用的指示剂是 。
②生成I2的反应的离子方程式是 。
(5)已知:2Fe2+ + Br2=2Fe3+ +2Br-。若将0.1 mol E通入100 mL FeBr2溶液中,溶液中有三分之一的Br-被氧化成Br2,则此反应离子方程式是 ,原FeBr2溶液的物质的量浓度为 。
下表是元素周期表的一部分.表中所列的字母分别代表某一化学元素.
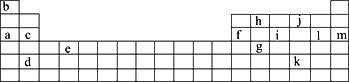
(1)下列________(填写编号)组元素的单质具有良好导电性.
①a、c、h
②b、g、k
③c、h、i
④d、e、f
(2)下表是一些气态原子失去核外不同电子所需的能量,(即电离能,单位为kJ·mol-1):
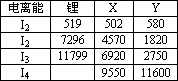
①为什么锂原子的第二电离能远远大于第一电离能________.
②表中X可能为以上13种元素中的________(填写字母)元素.用元素符号表示X和j形成化合物的化学式________.
③Y是周期表中________族元素.
④以上13种元素中,________(填写字母)元素原子失去核外第一个电子需要的能量最多.
|
对于N2+3H2 | |
A. |
生成氨的速率与NH3的分解速率相等 |
B. |
断开一个N |
C. |
N2、H2、NH3百分含量不再变化 |
D. |
总压强不变 |
E. |
N2、H2、NH3分子数之比为1∶3∶2的状态 |
F. |
N2、H2、NH3的浓度相等 |
G. |
N2、H2不再起反应 |
H. |
v(N2)= |
I. |
混合气密度不变 |
J. |
混合气平均式量不变 |
K. |
反应放出的热量等于反应吸收的热量 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com