
题目列表(包括答案和解析)
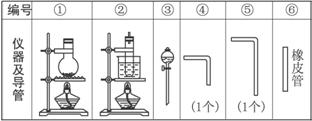
(1)组装氯气发生器时,应选用的仪器及导管是________________(填编号)。
(2)在实验中,按气流方向从左到右的顺序,气流流经的仪器及导管的编号依次是_________。
(3)仪器②试管的橡皮塞上应有____________个孔,原因是____________________________。
(4)仪器②中装试管是悬在烧杯中而不直接放入烧杯内是因为________________________。
(5)仪器②试管中需要50 g 30%的KOH溶液,那么称取固体KOH以及配制溶液的方法是_______________________________________________________________________________。
(6)欲将制得的氯酸钾从溶液中分离出来并制成晶体,应采取的方法是________________。
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示:
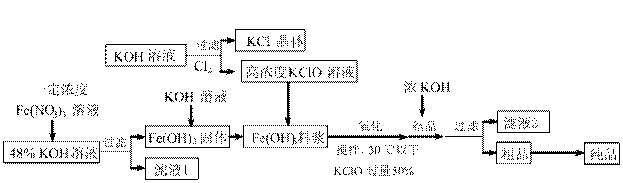
⑴在农业生产中,滤液1可用作 ▲ 。
⑵上述氧化过程中,发生反应的离子方程式是: ▲ ,控制反应温度30℃以下的原因是: ▲ 。
⑶结晶过程中加入浓KOH溶液的作用是: ▲ 。
⑷某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-离子的物质的量之比是1:2,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为 ▲ 。
⑸实验测得铁盐溶液的质量分数、反应时间与K2FeO4产率的实验数据分别如图1、图2所示。为了获取更多的高铁酸钾,铁盐的质量分数应控制在 ▲ 附近、反应时间应控制在 ▲ 。
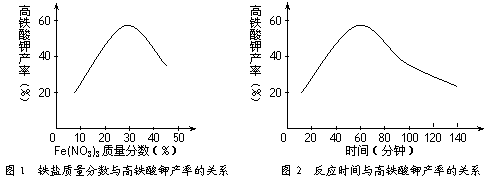
(14分)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示:
(1)在农业生产中,滤液1可用作 ▲ 。
(2)上述氧化过程中,发生反应的离子方程式是: ▲ ,控制反应温度30℃以下的原因是: ▲ 。
(3)结晶过程中加入浓KOH溶液的作用是: ▲ 。
(4)某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-离子的物质的量之比是1:2,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为 ▲ 。
(5)实验测得铁盐溶液的质量分数、反应时间与K2FeO4产率的实验数据分别如图1、图2所示。为了获取更多的高铁酸钾,铁盐的质量分数应控制在 ▲ 附近、反应时间应控制在 ▲ 。

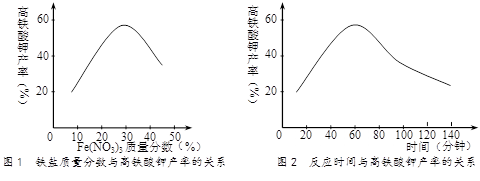
(14分)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示:
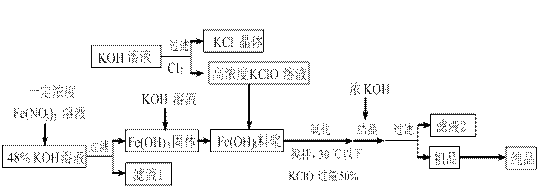
(1)在农业生产中,滤液1可用作  ▲ 。
▲ 。
(2)上述氧化过程中,发生反应的离子方程式是: ▲ ,控制反应温度30℃以下的原因是: ▲ 。
(3)结晶过程中加入浓KOH溶液的作用是: ▲ 。
(4)某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KCl O3的混合溶液,经测定ClO-与ClO3-离子的物质的量之比是1:2,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为 ▲ 。
O3的混合溶液,经测定ClO-与ClO3-离子的物质的量之比是1:2,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为 ▲ 。
(5)实验测得铁盐溶液的质量分数、反应时间与K2FeO4产率的实验数据分别如图1、图2所示。为了获取更多的高铁酸钾,铁盐的质量分数应控制在 ▲ 附近、反应时间应控制在 ▲ 。
(14分)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示:
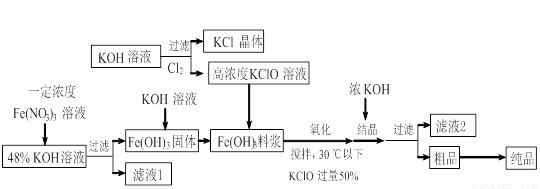
(1)在农业生产中,滤液1可用作 ▲ 。
(2)上述氧化过程中,发生反应的离子方程式是: ▲ ,控制反应温度30℃以下的原因是: ▲ 。
(3)结晶过程中加入浓KOH溶液的作用是: ▲ 。
(4)某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-离子的物质的量之比是1:2,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为 ▲ 。
(5)实验测得铁盐溶液的质量分数、反应时间与K2FeO4产率的实验数据分别如图1、图2所示。为了获取更多的高铁酸钾,铁盐的质量分数应控制在 ▲ 附近、反应时间应控制在 ▲ 。

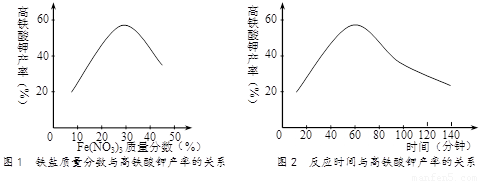
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com