
题目列表(包括答案和解析)
(1)已知某混合气体的成分按体积分数计算是:80.0%CH4、15.0%C2H4和5.00%C2H6.请计算0.5mol该混合气体的质量和标准状况下的密度(g·L-1).
(2)CH4在一定条件下催化氧化可以生成C2H4和C2H6(水和其他产物忽略不计).取一定量CH4经催化氧化后得到一种混合气体,它在标准状况下的密度为0.780g·L-1.已知反应中CH4消耗了20%,计算混合气中C2H4的体积分数.
已知某混合气体的成分按体积分数计算是:80.0% CH4、15.0% C2H4和5.00% C2H6。试计算:
(1)0.500 mol该混合气体的质量。
(2)该混合气体在标准状况下的密度。
(1)0.500 mol该混合气体的质量。
(2)该混合气体在标准状况下的密度。
(NH4)2PtCl6晶体受热分解,生成氮气、氯化氢、氯化铵和金属铂,在此分解反应中,氧化产物与还原产物的物质的量之比是
A.2:3 B.3:2 C.4:3 D.1:3
【解析】根据反应前后的元素的化合价变化可判断,N元素由-3价升高到0,即氮气是氧化产物,每生成1mol氮气转移6mol电子。Pt的化合价由+4价降低到0价,所以Pt是还原产物。根据得失电子守恒可知生成铂的物质的量是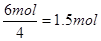 ,所以氧化产物和还原产物的物质的量之比是2:3,选项A正确。答案选A。
,所以氧化产物和还原产物的物质的量之比是2:3,选项A正确。答案选A。
Mg、Cu合金8.4g完全溶于浓硝酸中,若反应中硝酸被还原,只产生4480mLNO2和2240mLN2O4,反应后的溶液中加足量的NaOH溶液,生成的沉淀再经灼烧后所得固体质量为:
A.15.2 g, B.11.6g C.13.5g, D.16.6 g
【解析】根据反应过程不难判断,生成的沉淀是氢氧化镁和氢氧化铜,灼烧得到的是氧化镁和氧化铜,因为金属每失去2mol电子,就要结合1mol氧原子。硝酸的还原产物是NO2和N2O4,转移的电子是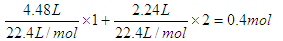 ,所以根据得失电子守恒可知,金属结合的氧原子是0.2mol,质量是0.2mol×16g/mol=3.2g,所以最终的固体质量是11.6g。即答案是B。
,所以根据得失电子守恒可知,金属结合的氧原子是0.2mol,质量是0.2mol×16g/mol=3.2g,所以最终的固体质量是11.6g。即答案是B。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com