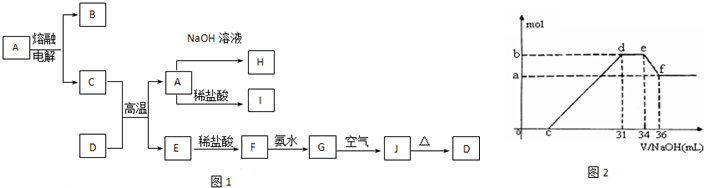
A-J是中学化学中常见的物质,它们之间的转化关系如框图1所示(部分产物已略去).已知A是一种高熔点物质,J是一种红褐色沉淀.请回答下列问题:
(1)A的化学式为
Al2O3
Al2O3
(2)H溶液中通入过量的CO
2,其反应的离子方程式是
[Al(OH)4]-+CO2═Al(OH)3↓+HCO3-
[Al(OH)4]-+CO2═Al(OH)3↓+HCO3-
G→J的化学方程式为
4Fe(OH)2+2H2O+O2═4Fe(OH)3
4Fe(OH)2+2H2O+O2═4Fe(OH)3
(3)D物质恰好溶于一定量的稀盐酸后,用合适的化学用语表示所得溶液显酸性的原因
Fe3++3H2O?Fe(OH)3+3H+
Fe3++3H2O?Fe(OH)3+3H+
(4)实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的C、E混合物 与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
①图2中oc段没有沉淀生成,此阶段发生反应的离子方程式为
H++OH-=H2O
H++OH-=H2O
.
②在de段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式
NH4++OH-=NH3?H2O
NH4++OH-=NH3?H2O
;
上述现象说明溶液中
H+
H+
结合OHˉ的能力最强(填离子符号).
③b与a的差值为
0.008mol
0.008mol
mol.

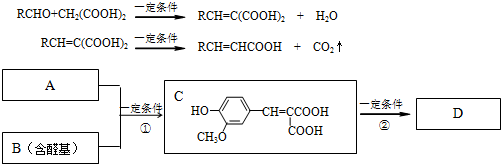


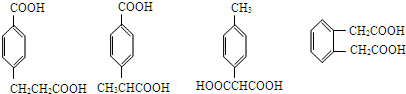 任意一种
任意一种 任意一种
任意一种