
题目列表(包括答案和解析)

| A | B | C | D | |
| 实验 | 用CCl4提取碘水中的I2 | 分离乙醇中的I2 | 加热分解 MgCl26H2O得到 纯净的MgCl2 |
配制100mL 10.1000mol/L K2Cr2O7溶液 |
| 装置或仪器 | 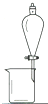 |
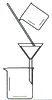 |
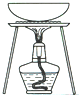 |
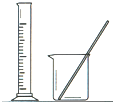 |
| A、A | B、B | C、C | D、D |
| 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ |
| FeSO4?7H2O | 15.6 | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 | - |
| (NH4)2SO4 | 70.6 | 73.0 | 75.4 | 78.0 | 81.0 | - | 88.0 |
| (NH4)2SO4?FeSO4?6H2O | 12.5 | 17.2 | 21.0 | 28.1 | 33.0 | 40.0 | 44.6 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com