
题目列表(包括答案和解析)
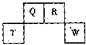 (2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:

| ||
| ||
| ||
| ||
(共5分)
环境中的二氧化碳气体可与水形成酸,或同岩石中的碱性物质发生反应,水体中的二氧化碳也可通过沉淀反应变为沉积物从水体中失去,在水与生物体之间的生物化学交换中,二氧化碳占有独特地位,在调节天然水体的pH及其组成方面起着非常重要的作用。在碳酸―天然水平衡体系中,部分生物学家认为碱度可以近似地表征水体的肥力,总碱度通常定义为:c(总碱度)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+)。现有一水体与CaCO3(s)相接触并达到平衡,请判断添加少量下列物质对溶液中钙离子浓度与总碱度的影响(忽略离子强度的影响)[填“增加”、“减少”或“不变”]。
添加物质 | KOH | KCl | Ca(NO3)2 | Na2CO3 | CO2 |
c(Ca2+) |
|
|
|
|
|
c(总碱度) |
|
|
|
|
|
| 高温 |
(13分)课本实验常存在一些不足,在学习过程中对其进行分析与改进是研究性学习的一个重要课题。下图甲是高一课本60页“铜丝在氯气中燃烧”的演示实验,铜丝在氯气中燃烧的主要现象是 。
有人对该实验提出了如下改进方案:
①按下图乙所示连接好装置,并检查气密性;
 ②取下注射器并集满Cl2;
②取下注射器并集满Cl2;
③点燃酒精灯加热1~2min后,再移开酒精灯。迅速将注射针插入石英玻璃管内,并将Cl2缓缓推入玻璃管中;
④拔出针头,再用同样方法快速向玻璃管中推入空气。
请回答:
(1)步骤③完成后,观察到铜丝继续保持红热状态,由此可判断,该反应为 反应(填“放热”或“吸热”)。
(2)步骤④完成后,发现具支试管中的蒸馏水变为蓝绿色。此时缓缓拉动针栓,使少量NaOH溶液吸入具支试管中,看到有色的沉淀产生,该反应的离子方程式为: 。
(3)该实验设计与课本实验相比较,其优点为 。
(4)步骤④完成后,具支试管中的蒸馏水之所以呈蓝绿色是因为CuCl2的浓度过大造成的。现有此具支试管中的10mL的5mol/L的浓CuCl2溶液来配制实验室所需的250mL的0.1mol/L的稀CuCl2溶液,配制操作步骤为:①计算 ② ③稀释 ④ ⑤ ⑥定容 ⑦摇匀。所需仪器有 、烧杯、玻璃棒、、 。
根据反应:2Na2CO3+SnO2+4S![]() Na2SO4+Na2SnS3+2CO2↑.
Na2SO4+Na2SnS3+2CO2↑.
回答下列问题:
1.上述反应涉及的元素中,非金属性最强的元素的最外层电子排布式为________.在上述反应的生成物中,属于分子晶体的结构式________.
2.在上述反应中单质物质的原子核外共有________种不同运动状态的电子,有________种不同能量的电子.
3.上述反应中,金属性最强的元素与铝元素相比较,可作为判断金属性强弱依据的是________(选填编号).
a.能否置换出铝盐溶液中铝
b.Al(OH)3能否溶解在该元素最高价氧化物对应水化物中
c.单质与氢气化合的难易程度
d.单质与同浓度的稀盐酸发生反应的快慢程度
4.常温下,测得Na2SnS3溶液pH>7,请用离子方程式表示其原因:________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com