
题目列表(包括答案和解析)
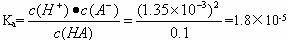
(1)恰好完全中和时(B点)溶液的pH_______7(填“>”“<”或“=”),理由是______________。
(2)当弱电解质AB在水溶液里达到平衡时:AB![]() A++B-,即有K电离=
A++B-,即有K电离=![]()
式中c(A+)·c(B-)、c(AB)分别表示粒子A+、B-、AB电离平衡时的物质的量浓度,K电离是弱电解质的电离平衡常数,简称电离常数,一定温度下,电离常数不随溶液浓度改变而改变,通过上述材料的阅读,求本题中一元弱酸的电离常数。
(3)求A点的pH。(lg1.35=0.13 lg1.8=0.26)
实验编号 | HCl物质的量浓度(mol·L-1) | BOH物质的量浓度(mol·L-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | 0.2 | c1 | pH=7 |
丙 | 0.1 | 0.2 | pH<7 |
丁 | 0.1 | 0.1 | pH=5 |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明BOH是强碱还是弱碱_____________________________。
(2)不考虑其他组的实验结果,单从乙组情况分析,c1是否一定等于0.2 mol·L-1____________(选填“是”或“否”)。混合溶液中离子浓度c(B+)与c(Cl-)的大小关系是____________。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,BOH是____________酸(选填“强”或“弱”)。
该混合溶液中离子浓度由大到小的顺序是____________。
(4)丁组实验所得混合溶液中由水电离出的c(H+)=____________mol·L-1。
写出该混合溶液中下列精确算式(不能做近似计算)。
c(Cl-)-c(B+)=________________________mol·L-1
c(H+)-c(BOH)=________________________mol·L-1
α=![]() ×100%
×100%
现有25 ℃时某一元强碱MOH溶液,pH=a,某一元弱酸HA溶液中,α(HA)=1.0%,pH=b。若将上述1体积的MOH溶液和10体积的HA溶液混合后恰好完全反应。下列说法正确的是
A.a+b=14
B.a+b=17
C.反应后溶液中水的电离度大于原MOH溶液中水的电离度
D.反应后溶液中水的电离度小于原HA溶液中水的电离度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com