(2011?扬州三模)(1)在短周期主族元素中,氯及其相邻两元素的电负性由大到小的顺序是
F>Cl>S
F>Cl>S
(用元素符号表示)
(2)A、B、C为同一短周期金属元素.依据下表数据分析,C元素在化合物中的主要化合价为
+3
+3
;A、B、C三种元素的原子半径由大到小的顺序是
Na>Mg>Al
Na>Mg>Al
.
| 电离能/kJ?mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
500 |
4600 |
6900 |
9500 |
| B |
740 |
1500 |
7700 |
10500 |
| C |
580 |
1800 |
2700 |
11600 |
(3)已知过氧化氢分子的空间结构如右图所示,分子中氧原子采取
sp3
sp3
杂化;
通常情况下,H
2O
2与水任意比互溶的主要原因是
H2O2分子H2O分子之间形成氢键,使H2O2与水任意比互溶
H2O2分子H2O分子之间形成氢键,使H2O2与水任意比互溶
.
(4)R是1~36号元素中未成对电子数最多的原子.R
3+在溶液中存在如下转化:R
3+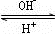
R(OH)
3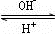
[R(OH)
4]
-①基态R原子的价电子排布式为
3d54s1
3d54s1
.②[R(OH)
4]
-中存在的化学键是
BD
BD
.
A.离子键 B.极性键 C.非极性键 D.配位键
(5)等电子体原理可广义理解为:重原子数相等(重原子指原子序数≥4),总电子数或价电子数相等的分子或离子.若将H
2O
2滴入液氨中,可得白色固体A,红外光谱显示,A中有阴阳两种离子,阳离子是正四面体,阴离子与H
2O
2互为等电子体.则A的结构简式为
NH4OOH
NH4OOH
.

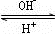 R(OH)3
R(OH)3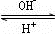 [R(OH)4]-
[R(OH)4]-