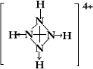
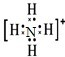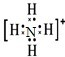硫、氮及其化合物与人类的生活有着密切关系
ⅠNO分子因污染空气而臭名昭著.近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究的热点,NO亦被称为“明星分子”.请回答下列问题.
(1)NO的危害在于
ACD
ACD
(填标号).
A.破坏臭氧层 B.高温下能使一些金属氧化
C.造成酸雨 D.与人体血红蛋白结合
(2)在含Cu
+离子的酶的活化中心中,亚硝酸根离子可转化为NO,写出Cu
+和亚硝酸根离子(NO
2-)在酸性水溶液中反应的离子方程式:
Cu++NO2-+2H+═Cu2++NO↑+H2O
Cu++NO2-+2H+═Cu2++NO↑+H2O
.
(3)已知NH
3和Cl
2会发生氧化还原反应,生成N
2和NH
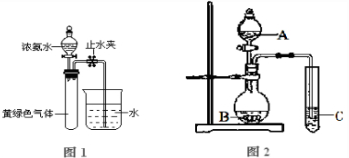
4Cl.现用如图1所示的装置进行实验,打开分液漏斗的活塞,滴下浓氨水,至不再反应为止;关闭分液漏斗的活塞,待恢复到室温,打开止水夹,试管内液面上升至三分之二处.
①写出实验室制取氨气的化学方程式
Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O
Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O
.
②试管内发生反应的化学方程式是
8NH3+3Cl2═N2+6NH4Cl
8NH3+3Cl2═N2+6NH4Cl
.
③试管中发生的反应表明氨气具有
bc
bc
(填标号).
a、氧化性 b、还原性 c、碱性 d、热不稳定性
Ⅱ(1)将SO
2通入由CuSO
4和NaCl混合的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀进行元素质量分数分析,知其中含Cl:35.7%,Cu:64.3%,则SO
2在上述反应中的作用是
c
c
(填标号).
a.漂白剂 b.氧化剂 c.还原剂
(2)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解.现改用H
2O
2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式
Cu+2H++H2O2═Cu2++2H2O
Cu+2H++H2O2═Cu2++2H2O
.
(3)用上图2实验装置可以证明硫、碳、硅三种元素的非金属性强弱.则A、B、C所代表的物质的名称:A
H2SO4
H2SO4
,B
NaHCO3或Na2CO3
NaHCO3或Na2CO3
,C
Na2SiO3
Na2SiO3
填化学式).