工业上用铝土矿(主要成分是Al
2O
3,还有少量的Fe
2O
3、SiO
2)提取冶炼铝的原料氧化铝,并分析该铝土矿中氧化铝的含量.工艺流程如图:
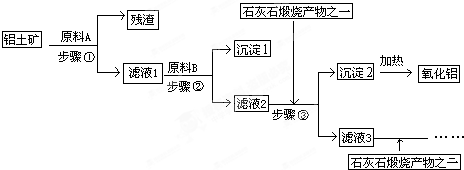
(1)残渣的成分是
SiO2
SiO2
(填化学式),原料A的名称是
盐酸
盐酸
,步骤①反应的离子方程式是
Al2O3+6H+=2Al3++3H2O;Fe2O3+6H+=2Fe3++3H2O
Al2O3+6H+=2Al3++3H2O;Fe2O3+6H+=2Fe3++3H2O
.
(2)滤液1中要加入稍过量原料B,原料B的化学式是
NaOH
NaOH
,步骤②反应的子方程式是:
H++OH-=H2O、Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O
H++OH-=H2O、Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O
.
(3)滤液3中的离子主要有
Na+、OH-、Cl-、HCO3-
Na+、OH-、Cl-、HCO3-
.该流程中哪些物质可循环使用
NaOH、CaCO3
NaOH、CaCO3
.
(4)如果省去步骤①,即溶解铝土矿是从加入原料B开始,则会对氧化铝的提取有什么影响
若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,最后使加热制得的Al2O3混有SiO2杂质
若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,最后使加热制得的Al2O3混有SiO2杂质
.
(5)步骤①②③中都要用到的物质分离的方法是
过滤
过滤
;步骤③后得到的沉淀要洗涤后才能灼烧,如何判断该沉淀已洗涤完全?
取滤液3的上层清液,通入二氧化碳,若出现浑浊,则说明沉淀不完全;若不出现浑浊,则说明沉淀完全
取滤液3的上层清液,通入二氧化碳,若出现浑浊,则说明沉淀不完全;若不出现浑浊,则说明沉淀完全
.
(6)某化学兴趣小组取A克铝土矿用以上流程进行实验,最终得到B克氧化铝,则计算该铝土矿中氧化铝的百分含量为
(用含A、B 的计算式表示).会导致该小组实验结果偏大的原因可能是:
B、C
B、C
A、未对沉淀1进行洗涤 B、未对沉淀2行洗涤
C、加热灼烧沉淀2时前后两次称量结果超过0.001克 D、步骤③所得混合物在分离时有液体溅出.

 已知:①HSO3-的还原性比I-强,②IO3-+5I-+6H+=3I2+3H2O.工业上利用NaIO3和NaHSO3反应来制取单质I2.NaIO3来源于自然界的矿物,NaHSO3来源于硫酸工厂尾气处理的产物(用NaOH溶液吸收SO2).
已知:①HSO3-的还原性比I-强,②IO3-+5I-+6H+=3I2+3H2O.工业上利用NaIO3和NaHSO3反应来制取单质I2.NaIO3来源于自然界的矿物,NaHSO3来源于硫酸工厂尾气处理的产物(用NaOH溶液吸收SO2).
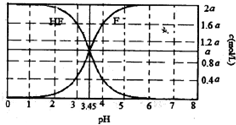 25℃时,2amol?L-1氢氟酸水溶液中,用NaOH溶液调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系如图所示.下列说法正确的是( )
25℃时,2amol?L-1氢氟酸水溶液中,用NaOH溶液调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系如图所示.下列说法正确的是( )