
题目列表(包括答案和解析)
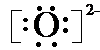
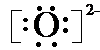
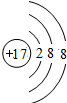

| ||
| ||
某研究性学习小组为了证明某酸HmA是强酸还是弱酸,设计了如下实验方案,请回答有关问题:
⑴当m=1时,测定0.1mol/L HA的pH值,若0.1mol/L HA的pH>1,说明HA为 酸(填“强”、 “弱”)。
测定0.1mol/L HA的值时,pH试纸预先 用蒸馏水湿润(填“能”、“不能”)。
⑵取少量NamA固体溶于蒸馏水,再向得到的溶液中滴加2滴石蕊,若溶液由无色变成蓝色,证明HmA是 酸(填“强”、 “弱”)。
若某浓度的NamA溶液pH=9,则该溶液中,水电离的C(H+)= mol/L
⑶室温下,将pH=2的酸HmA和pH=12的B(OH)n等体积混合,测得混合液的pH=8。
①写出生成正盐的化学方程式
②若该盐中只有一种能水解的离子,则HmA为 酸(填“强”、 “弱”), 离子水解的方程式为
⑷现有某浓度的HmA溶液,蒸馏水,常见指示剂(如:石蕊、酚酞),pH试纸以及常用实验仪器,请你设计一种简单可行的实验方案,证明HmA是强酸还是弱酸。简述实验过程、现象、结论:
。
某研究性学习小组为了证明某酸HmA是强酸还是弱酸,设计了如下实验方案,请回答有关问题:
⑴当m=1时,测定0.1mol/L HA的pH值,若0.1mol/L HA的pH>1,说明HA为 酸(填“强”、 “弱”)。
测定0.1mol/L HA的值时,pH试纸预先 用蒸馏水湿润(填“能”、“不能”)。
⑵取少量NamA固体溶于蒸馏水,再向得到的溶液中滴加2滴石蕊,若溶液由无色变成蓝色,证明HmA是 酸(填“强”、 “弱”)。
若某浓度的NamA溶液pH=9,则该溶液中,水电离的C(H+)= mol/L
⑶室温下,将pH=2的酸HmA和pH=12的B(OH)n等体积混合,测得混合液的pH=8。
①写出生成正盐的化学方程式
②若该盐中只有一种能水解的离子,则HmA为 酸(填“强”、 “弱”), 离子水解的方程式为
⑷现有某浓度的HmA溶液,蒸馏水,常见指示剂(如:石蕊、酚酞),pH试纸以及常用实验仪器,请你设计一种简单可行的实验方案,证明HmA是强酸还是弱酸。简述实验过程、现象、结论:
。
某研究性学习小组为了证明某酸HmA是强酸还是弱酸,设计了如下实验方案,请回答有关问题:
⑴当m=1时,测定0.1mol/L HA的pH值,若0.1mol/L HA的pH>1,说明HA为 酸(填“强”、 “弱”)。
测定0.1mol/L HA的值时,pH试纸预先 用蒸馏水湿润(填“能”、“不能”)。
⑵取少量NamA固体溶于蒸馏水,再向得到的溶液中滴加2滴石蕊,若溶液由无色变成蓝色,证明HmA是 酸(填“强”、 “弱”)。
若某浓度的NamA溶液pH=9,则该溶液中,水电离的C(H+)= mol/L
⑶室温下,将pH=2的酸HmA和pH=12的B(OH)n等体积混合,测得混合液的pH=8。
①写出生成正盐的化学方程式
②若该盐中只有一种能水解的离子,则HmA为 酸(填“强”、 “弱”), 离子水解的方程式为
⑷现有某浓度的HmA溶液,蒸馏水,常见指示剂(如:石蕊、酚酞),pH试纸以及常用实验仪器,请你设计一种简单可行的实验方案,证明HmA是强酸还是弱酸。简述实验过程、现象、结论:
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com