
题目列表(包括答案和解析)
 和
和  ⑥
⑥ 和
和  ⑦C2H2和C4H6 ⑧
⑦C2H2和C4H6 ⑧ 和
和  ⑨乙醇和甲醚 ⑩淀粉和纤维素?CH3CH2NO2和
⑨乙醇和甲醚 ⑩淀粉和纤维素?CH3CH2NO2和 ?2甲基1,3丁二烯和异戊二烯;
?2甲基1,3丁二烯和异戊二烯; 等 碎片组成的,且数量众多.现在请你写出由上述碎片组成的、相对分子质量最小的一种烷烃的结构简式,并用系统命名法命名.
等 碎片组成的,且数量众多.现在请你写出由上述碎片组成的、相对分子质量最小的一种烷烃的结构简式,并用系统命名法命名. (2,2,4-三甲基戊烷),或
(2,2,4-三甲基戊烷),或 (2,2,3-三甲基戊烷),或
(2,2,3-三甲基戊烷),或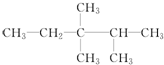 (2,3,3-三甲基戊烷)
(2,3,3-三甲基戊烷) (2,2,4-三甲基戊烷),或
(2,2,4-三甲基戊烷),或 (2,2,3-三甲基戊烷),或
(2,2,3-三甲基戊烷),或 (2,3,3-三甲基戊烷)
(2,3,3-三甲基戊烷)


| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
| NH3?H2O的Kb | Zn 2+完全沉淀的pH | Zn(OH)2溶于碱的pH |
| 1.8×10-5 | 8.9 | >11 |
| ||
| ||
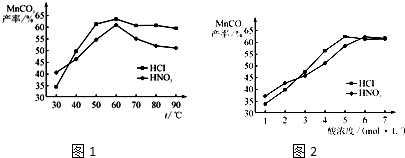

实验步骤如下:
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有________。
(a)容量瓶________(b)烧杯________(c)烧瓶?
(2)步骤Ⅱ取样分析溶液中的Fe2+、Fe3+的含量,目的是________。?
(a)控制溶液中Fe2+与Fe3+含量比?
(b)确定下一步还原所需铁的量?
(c)确定氧化Fe2+所需NaClO3的量?
(d)确保铁的氧化物酸溶完全?
(3)用NaClO3氧化时反应方程式如下:?
6FeSO4+NaClO3+3H2SO4![]() 3Fe2(SO4)3+NaCl+3H2O
3Fe2(SO4)3+NaCl+3H2O
若改用HNO3氧化,则反应方程式如下?
6FeSO4+2HNO3+3H2SO4![]() 3Fe2(SO4)3+NO↑+4H2
3Fe2(SO4)3+NO↑+4H2
已知1 mol HNO3价格为0.16元、1 mol NaClO3价格为0.45元,评价用HNO3代替NaClO3作氧化剂的利弊,利是________,弊是________。
(4)聚合硫酸铁溶液中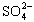 与Fe3+物质的量之比不是3∶2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中
与Fe3+物质的量之比不是3∶2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中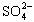 与Fe3+物质的量之比。?
与Fe3+物质的量之比。?
测定时所需的试剂________。?
(a) NaOH (b)FeSO4 (c) BaCl2 (d) NaClO3?
(5)需要测定________和________的质量(填写化合物的化学式)。?
(6)选出测定过程中所需的基本操作________(按操作先后顺序列出)。?
(a)萃取、分液 (b)过滤、洗涤 (c)蒸发、结晶 (d)冷却、称量 (e)烘干或灼烧?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com