
题目列表(包括答案和解析)
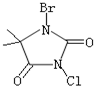 (2010?江苏一模)开发具有广谱、高效、低毒的杀菌、消毒剂是今后发展的趋势.
(2010?江苏一模)开发具有广谱、高效、低毒的杀菌、消毒剂是今后发展的趋势.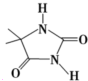

| T/℃t/min pH | 3.0 | 4.0 | 5.0 | 6.0 | 20 | 301 | 231 | 169 | 58 | 30 | 158 | 108 | 48 | 15 | 50 | 31 | 26 | 15 | 7 |

| ||
| △ |
| ||
| △ |
钴(Co)的氧化物是一种重要的化工原料,工业上利用CoCO3+O2→CoxOy+ CO2反应来生产相应的钴的氧化物。实验室中可以用下列装置来制取钴的氧化物并测定其分子组成。

请填写下列空白:
(1)写出A装置的大试管里发生反应的化学方程式 ;
(2)E装置的U形管里盛放的物质是 ;
A.P2O5 B.无水CaCl2 C.碱石灰 D.无水CuSO4
(3)O3的氧化性比O2强。已知制得的O2中含有少量的Cl2和O3,则B装置中所盛放的物质是
A.NaOH溶液 B.饱和NaHCO3溶液 C.饱和NaCI溶液 D.KI溶液
(4)实验结束时,若先撤去A装置中的酒精灯,会引起 ;
(5)在CoCO3完全转化为CoxOy后,若称得E管增重4.40g,D管内残留物质的质量是8.30g,则生成CoxOy的化学式为 ;
(6)此实验装置存在一个比较大的缺陷,如何完善 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com