
题目列表(包括答案和解析)

| ||
| ||
| ||
| ||
| ||
| ||


| ||
| ||
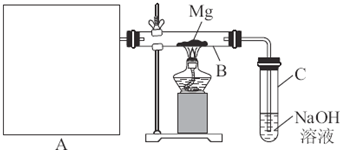
某研究性学习小组为了研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)
实验选用细铜丝、98.3%H2SO4、品红溶液、澄清石灰水、CC14、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。
|
以下是该学习小组部分交流记录及后续探究实验的记录。
材料一:小组交流滴录
学生1:加热前,无现象发生;加热后,液面下铜丝变黑,产生气泡,有细小黑色颗粒状物质从铜丝表面进入浓硫酸中,黑色物质是什么?值得探究!
学生2:我也观察到黑色颗粒状物质,后来逐渐转变为灰白色固体,我想该灰白色固体极有可能是未溶于浓硫酸的CuSO4。
学生3:你们是否注意到液面以上的铜丝也发黑,而且试管上部内壁有少量淡黄色S固体凝聚,会不会液面以上的铜丝与硫发生了反应,我查资料发现:2Cu+S=Cu2?S(黑色)。
材料二:探究实验剪辑
实验1:将光亮的铜丝在酒精灯火焰上灼烧变黑,然后插入稀硫酸中,铜丝重新变得光亮,溶液呈蓝绿色;将光亮的铜丝置入加热的硫蒸气中变黑,然后插入稀硫酸中无变化。
实验2:截取浓硫酸液面上方变黑的铜丝,插入稀硫酸中无变化;将浓硫酸液面下方变黑的铜丝,插入稀硫酸、黑色明显变浅,溶液呈蓝绿色。
实验3:将溶液中的黑色颗粒状物质,经过滤、稀硫酸洗、蒸馏水洗、干燥后放入氧气流中加热,然后冷却,用电子天平称重发现质量减少10%左右。
根据上述材料回答下列问题:
(1)D、E两支试管中CC14的作用是 ;
(2)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式: ;
(3)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。学生1猜想是由于SO2溶解度较大,生成了Ca(HSO3)2的缘故。请你设计实验验证学生1的猜想
;
(4)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是 ;(写化学式)Ks5u
(5)反应完全后稀释溶液呈酸性,学生2猜想反应中浓硫酸可能过量,请你设计一个简单的实验以验证稀释后的溶液由于硫酸过量呈酸性, 。
工业制纯碱时,第一步是通过饱和食盐水、氧和二氧化碳反应,获得碳酸氢钠晶体.它的反应原理可以用下面方程式表示:
NH3+CO2+H2O![]() NH4HCO3
NH4HCO3
NH4HCO3+NaCl(饱和)![]() NaHCO3↓+NH4Cl
NaHCO3↓+NH4Cl
以上反应总结果是放热反应.请设计一个实验,用最简单的实验装置模拟实现这一过程,获得NaHCO3晶体.可供选择的实验用品有:6 mol·L-1盐酸、6 mol·L-1的硫酸、浓氨水、氢氧化钠、消石灰、石灰石、氯化铵、食盐、蒸馏水、冰,以及中学化学常用仪器.
(1)画出实验装置示意图(包括反应时容器中的物质),并在图中玻璃容器旁从左至右分别用A,B,C……符号标明.
(2)请写出在图上用A,B,C……标明的各玻璃容器中盛放物质的化学式或名称.
(3)利用本题所提供的实验用品,如何判断得到的产品是碳酸氢钠的结晶,而不是碳酸氢铵或食盐结晶.
说明:①本题装置示意图中的仪器可以用下面的方式表示:
敞开玻璃容器![]() 有塞玻璃容器
有塞玻璃容器![]()
玻璃漏斗 分液漏斗
分液漏斗![]()
玻璃导管![]() (但应标示出在液面上或液面下)
(但应标示出在液面上或液面下)
②铁架台、石棉网、酒精灯、玻璃导管之间的联接胶管等,在示意图中不必画出.如需加热,在需加热的仪器下方,标以“△”表示.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com