
题目列表(包括答案和解析)
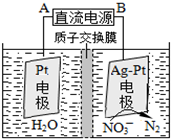 氮氧化合物是大气污染的重要因素.
氮氧化合物是大气污染的重要因素.| 催化剂 |


 催化剂
催化剂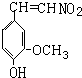





| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
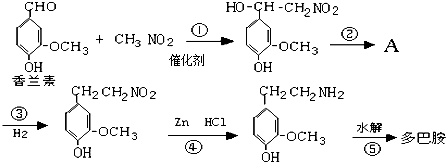
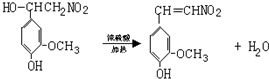
 快乐是什么?精神病学专家通过实验发现:在大脑的相应部位--“奖赏中心”,给予柔和的电击,便会处于似乎极度快乐的状态.人们已经将“奖赏中心”各部分的脑电图绘制出来,并认为,在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心”又称为多巴胺系统.多巴胺结构如图:
快乐是什么?精神病学专家通过实验发现:在大脑的相应部位--“奖赏中心”,给予柔和的电击,便会处于似乎极度快乐的状态.人们已经将“奖赏中心”各部分的脑电图绘制出来,并认为,在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心”又称为多巴胺系统.多巴胺结构如图:


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com