
题目列表(包括答案和解析)
铁及其化合物在日常生活中应用广泛,请回答下列问题:
(1)Fe(NO3)3?9H2O易溶于水,微溶于硝酸,主要用作催化剂和媒染剂。工业上用细铁屑与稀硝酸反应制备,主要流程如下:
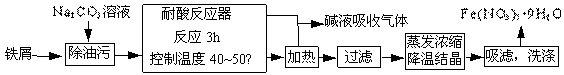
①Na2CO3 溶液可以除油污,原因是(用离子方程式表示) ;
②耐酸反应器中可以观察到的现象是 ;制备过程中需控制加入铁屑的量,当观察到 的现象时应停止加入铁屑;
③制得的Fe(NO3)3?9H2O用20% HNO3洗涤,其原因是 ;
④若在实验室中进行蒸发浓缩、降温结晶的操作,则所需的仪器有 ;
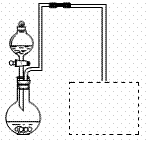
(2)某兴趣小组在实验室用右图装置制取Fe(NO3)3
 (固定所用仪器和加热装置未画出)。
(固定所用仪器和加热装置未画出)。
①该实验中对圆底烧瓶加热的最佳方式用 加热;
②装置中圆底烧瓶上方长导管的作用是 ;
③请在图中虚线框内画出防止倒吸的尾气吸收装置
(提示:碱液可快速、充分吸收产生的氮氧化物气体)。
铁及其化合物在日常生活中应用广泛,请回答下列问题:
(1)Fe(NO3)3·9H2O易溶于水,微溶于硝酸,主要用作催化剂和媒染剂。工业上用细铁屑与稀硝酸反应制备,主要流程如下:

①Na2CO3 溶液可以除油污,原因是(用离子方程式表示) ;
②耐酸反应器中可以观察到的现象是 ;制备过程中需控制加入铁屑的量,当观察到 的现象时应停止加入铁屑;
③制得的Fe(NO3)3·9H2O用20% HNO3洗涤,其原因是 ;
 ④若在实验室中进行蒸发浓缩、降温结晶的操作,则所需的仪器有 ;
④若在实验室中进行蒸发浓缩、降温结晶的操作,则所需的仪器有 ;
(2)某兴趣小组在实验室用右图装置制取Fe(NO3)3
(固定所用仪器和加热装置未画出)。
①该实验中对圆底烧瓶加热的最佳方式用 加热;
②装置中圆底烧瓶上方长导管的作用是 ;
③请在图中虚线框内画出防止倒吸的尾气吸收装置
(提示:碱液可快速、充分吸收产生的氮氧化物气体)。
| |||||||||||||||||||
| Fe |
| Fe |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com