
题目列表(包括答案和解析)
在图中x%为气态反应物在平衡体系中的质量分数,该图表示x%、同温度、压强的关系,符合曲线反应的是
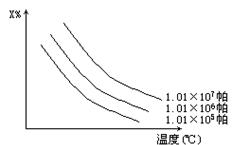
A.2NH3(气)![]() N2(气)+3H2-Q
N2(气)+3H2-Q
B.H2(气)+I2(气)![]() 2HI(气)+Q
2HI(气)+Q
C.4NH3(气)+3O2(气)![]() 2N2(气)+6H2O(气)+Q
2N2(气)+6H2O(气)+Q
D.C(固)+H2O(气)![]() H2(气)+CO(气)-Q
H2(气)+CO(气)-Q
A.2NH3(气) N2(气)+3H2-Q N2(气)+3H2-Q |
B.H2(气)+I2(气) 2HI(气)+Q 2HI(气)+Q |
C.4NH3(气)+3O2(气)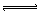 2N2(气)+6H2O(气)+Q 2N2(气)+6H2O(气)+Q |
D.C(固)+H2O(气)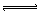 H2(气)+CO(气)-Q H2(气)+CO(气)-Q |
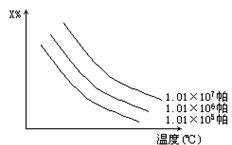
在图A中,x%为气态反应物在平衡体系中的体积分数,该图表示x%同温度、压强的关系。符合该图的反应是 ( )。
①2NH3(g) N2(g)+3H2(g)(正反应吸热)
N2(g)+3H2(g)(正反应吸热)
②H2(g)+I2(g)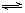 2HI(g)(正反应放热)
2HI(g)(正反应放热)
③4NH3(g)+3O2(g)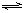 2N2(g)+ 6H2O(g)(正反应放热)
2N2(g)+ 6H2O(g)(正反应放热)
④C(s)+H2O(g)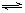 H2(g)+CO(g) (正反应吸热)
H2(g)+CO(g) (正反应吸热)
A.①② B.②④
C.①④ D.③④
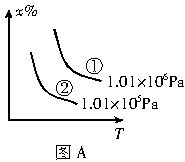
 已知反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,生成的CO2与H2以不同的体积比混合时在合适条件下的反应可制得CH4.
已知反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,生成的CO2与H2以不同的体积比混合时在合适条件下的反应可制得CH4.| 1 | 2 |
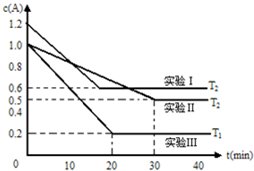 恒容体系,发生如下反应2A(g)?B(g)+xC(?)△H,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如图(某课外活动小组一共进行了如图所示的三个实验,其中T1、T2表示不同的反应温度):
恒容体系,发生如下反应2A(g)?B(g)+xC(?)△H,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如图(某课外活动小组一共进行了如图所示的三个实验,其中T1、T2表示不同的反应温度):| c(B)?c(C) |
| c2(A) |
| c(B)?c(C) |
| c2(A) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com