
题目列表(包括答案和解析)
| |||||||||||||||
硫代硫酸钠 俗称大苏打或海波,是无色或淡黄色结晶,能风化和潮解,纯品可作照相定影剂、去氯剂和分析试剂,还用于皮革、纺织等工业.
俗称大苏打或海波,是无色或淡黄色结晶,能风化和潮解,纯品可作照相定影剂、去氯剂和分析试剂,还用于皮革、纺织等工业.
(1)工业上制取硫代硫酸钠 ,用
,用 和硫粉在水溶液中加热反应而得到.但在混合前,一般先用少许乙醇浸润,其原因是什么?
和硫粉在水溶液中加热反应而得到.但在混合前,一般先用少许乙醇浸润,其原因是什么?
(2)又知: 通过析出硫的速率可以说明反应速率的快慢,请判断下列几种情况下,最先看到硫析出的是
通过析出硫的速率可以说明反应速率的快慢,请判断下列几种情况下,最先看到硫析出的是
[ ]

(3)对于上述反应,如果温度每升高10,反应速率增加为原来的3倍.那么20℃时看到沉淀开始析出的时间需54s,若将温度提高到50℃,看到沉淀开始析出的时间需______s.
硫代硫酸钠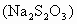 俗称大苏打或海波,是无色或淡黄色结晶,能风化和潮解,纯品可作照相定影剂、去氯剂和分析试剂,还用于皮革、纺织等工业.
俗称大苏打或海波,是无色或淡黄色结晶,能风化和潮解,纯品可作照相定影剂、去氯剂和分析试剂,还用于皮革、纺织等工业.
(1)工业上制取硫代硫酸钠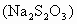 ,用
,用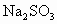 和硫粉在水溶液中加热反应而得到.但在混合前,一般先用少许乙醇浸润,其原因是什么?
和硫粉在水溶液中加热反应而得到.但在混合前,一般先用少许乙醇浸润,其原因是什么?
(2)又知: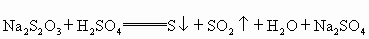 通过析出硫的速率可以说明反应速率的快慢,请判断下列几种情况下,最先看到硫析出的是
通过析出硫的速率可以说明反应速率的快慢,请判断下列几种情况下,最先看到硫析出的是
[ ]
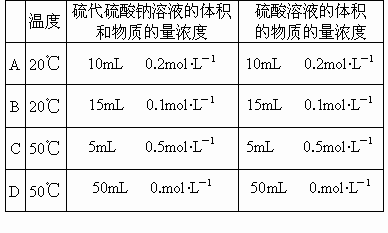
(3)对于上述反应,如果温度每升高10,反应速率增加为原来的3倍.那么20℃时看到沉淀开始析出的时间需54s,若将温度提高到50℃,看到沉淀开始析出的时间需______s.
硫代硫酸钠(Na2S2O3)俗称大苏打或海波,是无色或淡黄色结晶,能风化和潮解,纯品可作照相定影剂、去氯剂和分析试剂,还用于皮革、纺织等工业.
(1)工业上制取硫代硫酸钠(Na2S2O3),用Na2SO3和硫粉在水溶液中加热反应而得到.但在混合前,一般先用少许乙醇浸润,其原因是什么?
(2)又知:Na2S2O3+H2SO4![]() S↓+SO2↑+H2O+Na2SO4通过析出硫的速率可以说明反应速率的快慢,请判断下列几种情况下,最先看到硫析出的是( )
S↓+SO2↑+H2O+Na2SO4通过析出硫的速率可以说明反应速率的快慢,请判断下列几种情况下,最先看到硫析出的是( )

(3)对于上述反应,如果温度每升高10℃,反应速率增加为原来的3倍.那么20℃时看到沉淀开始析出的时间需54 s,若将温度提高到50℃,看到沉淀开始析出的时间需________s.
下图为元素周期表的一部分,根据元素①~⑧在周期表中的位置,按要求回答下列问题。
| 族 周期 | IA | | 0 | |||||
| 1 | ① | IIA | IIIA | ⅣA | VA | ⅥA | VIIA | |
| 2 | | | | | | ② | ③ | |
| 3 | ④ | ⑤ | | | | ⑥ | ⑦ | ⑧ |
| | 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | ||||
| 第一组 | 1 | 40 | FeCl3溶液 | 快速产生大量气泡 | 相同条件下,温度升高,化学反应速率加快 |
| 2 | 20 | A | 缓慢产生适量气泡 | ||
| 3 | 5 | FeCl3溶液 | 缓慢产生极少量气泡 | ||
| 第二组 | 4 | t | MnO2 | 快速产生大量气泡 | |
| 5 | 20 | 无 | 缓慢产生极少量气泡 | ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com