
题目列表(包括答案和解析)
(8分)最近雾霾天气又开始肆虐我国大部分地区。其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,吸收液为Na2SO3溶液,该吸收反应的离子方程式是
(2)已知H2SO3的电离常数为 K1=1.54×10-2 , K2=1.02×10-7, H2CO3的电离常数为 K1=4.30×10-7, K2= 5.60×10-11,则下列微粒可以共存的是_____________。
A.CO32- HSO3- B.HCO3- HSO3-
C.SO32- HCO3- D.H2SO3 HCO3-
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣):n(HSO3﹣)变化关系如下表:
|
n(SO3²﹣):n(HSO3﹣) |
91 :9 |
1 :1 |
1 :91 |
|
pH |
8.2 |
7.2 |
6.2 |
①上表判断NaHSO3溶液显 性,从原理的角度解释原因
②在NaHSO3溶液中离子浓度关系不正确的是(选填字母):
A.(Na+)= 2c(SO32-)+ c(HSO3-),
B.(Na+)> c(HSO3-)> c(H+)> c(SO32-)> c(OH-),
C.(H2SO3)+ c(H+)= c(SO32-)+ (OH-),
D.(Na+)+ c(H+)= 2 c(SO32-)+ c(HSO3-)+ c(OH-)
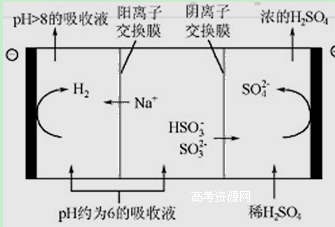
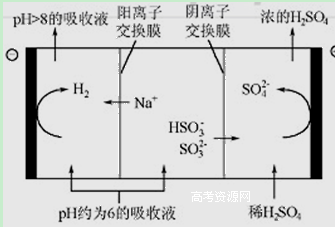
(4)当吸收液的pH降至约为6时,需送至电解槽再生 。再生示意图如下:

① 吸收液再生过程中的总反应方程式是 。
② 当电极上有1mol电子转移时阴极产物为 克.
(8分)请选择合适方法的字母代号填空:
(1)从煤焦油中提取二甲苯________;
(2)从海水中提取粗盐________;
(3)十六烷转变为辛烷和辛烯________;
(4)轻柴油转变为乙烯、丙烯等不饱和烃________;
(5)煤转化为焦炭、煤焦油等________;
(6)工业上由氧化铝制取金属铝________;
(7)从铁矿石中提取金属铁________;
(8)提纯氢氧化铁胶体(除去其中的杂质离子)________。
A.过滤 B.裂解 C.分馏 D.裂化 E.干馏 F.还原 G.电解 H.溶解
I.渗析 J.蒸发 K.氧化
(8分)最近雾霾天气又开始肆虐我国大部分地区。其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,吸收液为Na2SO3溶液,该吸收反应的离子方程式是
(2)已知H2SO3的电离常数为 K1=1.54×10-2 , K2=1.02×10-7, H2CO3的电离常数为 K1=4.30×10-7, K2= 5.60×10-11,则下列微粒可以共存的是_____________。
A.CO32- HSO3- B.HCO3- HSO3-
C.SO32- HCO3- D.H2SO3 HCO3-
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣):n(HSO3﹣)变化关系如下表:
| n(SO3²﹣):n(HSO3﹣) | 91 :9 | 1 :1 | 1 :91 |
| pH | 8.2 | 7.2 | 6.2 |
| n(SO3²﹣):n(HSO3﹣) | 91 :9 | 1 :1 | 1 :91 |
| pH | 8.2 | 7.2 | 6.2 |
用(A)质子数,(B)中子数,(C)核外电子数,(D)最外层电子数,(E)电子层数填写下列各空格.
(1)原子种类由________决定;
(2)元素种类由________决定;
(3)元素有同位素由________决定;
(4)同位素原子量由________决定;
(5)元素的原子半径由________决定;
(6)元素的化合价主要由________决定;
(7)元素的化学性质主要由________决定;
(8)价电子数通常是指________;
(9)核电荷数由________决定.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com