
题目列表(包括答案和解析)
(12分)氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活中的事例中发生了氧化还原反应的是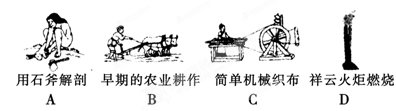
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如图表达。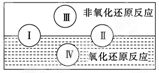
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:
其中水为________剂。
(3)“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强。
①该过程反应的化学方程式为__________________________。
②人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜,该过程中发生的离子反应方程式如下,请补充完整并配平:
________Cu2S+________Fe3++______H2O________Cu2++________Fe2++________( )+________SO42-。
(4)羟胺(NH2OH)是一种还原剂,用25.00 mL 0.049 mol/L羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+离子恰好与24.5 mL 0.020 mol/L的KMnO4酸性溶液反应。则在上述反应中,羟胺的氧化产物是 。
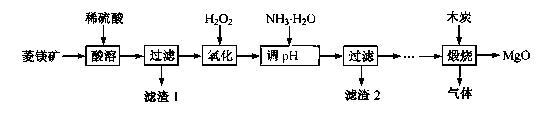
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下:
生成氢氧化物沉淀的pH
|
|
Mg(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
开始沉淀时 |
9.4 |
6.3 |
1.5 |
|
完全沉淀时 |
12.4 |
8.3 |
2.8 |
(1)MgCO3与稀硫酸反应的离子方程式为 。
(2)加氨水调节溶液的PH范围为 。
(3)滤渣2 的成分是 (填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C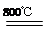 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C MgO+S↓+3CO↑
MgO+S↓+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。
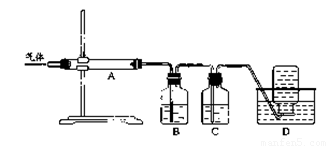
①D中收集的气体是 (填化学式)。
②B中盛放的溶液是 (填字母)。
a.NaOH 溶液 b.Na2CO3 溶液 c.稀硫酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式: 。
(12分)氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活中的事例中发生了氧化还原反应的是
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如图表达。
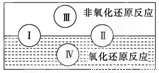
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:
其中水为________剂。
(3)“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强。
①该过程反应的化学方程式为__________________________。
②人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜,该过程中发生的离子反应方程式如下,请补充完整并配平:
________Cu2S+________Fe3++______H2O________Cu2++________Fe2++________( )+________SO42-。
(4)羟胺(NH2OH)是一种还原剂,用25.00 mL 0.049 mol/L羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+离子恰好与24.5 mL 0.020 mol/L的KMnO4酸性溶液反应。则在上述反应中,羟胺的氧化产物是 。
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下:
生成氢氧化物沉淀的pH
| | Mg(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 9.4 | 6.3 | 1.5 |
| 完全沉淀时 | 12.4 | 8.3 | 2.8 |
 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑ MgO+SO2↑+CO↑
MgO+SO2↑+CO↑  MgO+S↓+3CO↑
MgO+S↓+3CO↑
 反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为l mol SO3(g)的△H= -99 kJ/mol
反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为l mol SO3(g)的△H= -99 kJ/mol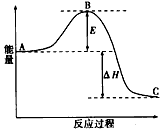
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com