
题目列表(包括答案和解析)
 nC(气)+2D(气),5分钟时反应达平衡状态,生成1摩D; 经测定,以C表示的平均反应速度为0.1摩/(升?分),下列结论中错误的是
nC(气)+2D(气),5分钟时反应达平衡状态,生成1摩D; 经测定,以C表示的平均反应速度为0.1摩/(升?分),下列结论中错误的是
| A.①、② | B.①、④ | C.②、③ | D.③、④ |
(13分)已知M是无色液体,C、H、D是有刺激性气味的气体,且D是单质,E为三原子非极性分子,②是工业上制取F的反应,J为漂白粉的有效成份。(部分反应条件未列出)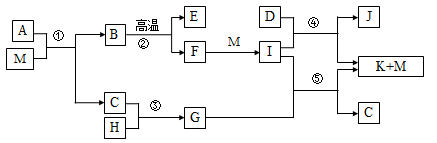
请回答下列问题:
(1)E、D、J的化学式分别是 、 、 ,G的电子式
(2)反应④的化学方程式
(3) 简述C的一种用途:
(4) A由三种元素组成,1 mol A与M反应可生成1 mol B和2 mol C,则A的化学式是
(5)漂白粉常用作消毒剂、杀菌剂、漂白剂等。漂白粉是一种混合物,漂白粉质量高低由"有效氯"(过量酸与漂白粉作用生成的氯气的质量与漂白粉的质量比)决定。漂白粉样品2.00克,加水研磨后,转入250毫升容量瓶内,用水稀释至刻度,摇匀后,取出25.0毫升,加入过量的KI溶液和过量的稀硫酸,静置。待漂白粉放出的氯气与KI完全反应后,用0.100摩/升的Na2S2O3标准溶液滴定反应中生成的碘。反应如下:2Na2S2O3+I2=Na2S4O6+2NaI滴定时用去Na2S2O3溶液20.0毫升。计算该漂白粉中有效氯的百分含量。
已知漂白粉与酸的反应为:Ca(ClO)2+CaCl2+2H2SO4=2CaSO4+2Cl2↑+2H2O
(14分)某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行了有关实验:
(1). B是用来收集实验中产生的气体的装置,但未将导管画全,请直接在原图上把导管补充完整。
(2).向50毫升18摩/升的H2SO4溶液中加入足量的铜片并加热,充分反应后,
①请写出铜跟浓硫酸反应的化学方程式:_____________________________,写出C中发生反应的离子方程式 。
②被还原的H2SO4的物质的量
A 小于0.45摩 B等于0.45摩
C 在0.45摩与0.90摩之间 D大于0.90摩
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是_________ (填写字母编号,有几个写几个,多写或写错0分)。
A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(3) 常温下,将铁棒置于浓硫酸中.无明显现象,课本上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面 ,则发生了钝化,若铁棒表面________,则铁和浓硫酸未发生反应。
(14分)某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行了有关实验:

(1). B是用来收集实验中产生的气体的装置,但未将导管画全,请直接在原图上把导管补充完整。
(2).向50毫升18摩/升的H2SO4溶液中加入足量的铜片并加热,充分反应后,
①请写出铜跟浓硫酸反应的化学方程式:_____________________________,写出C中发生反应的离子方程式 。
②被还原的H2SO4的物质的量
A 小于0.45摩 B 等于0.45摩
C 在0.45摩与0.90摩之间 D 大于0.90摩
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是_________ (填写字母编号,有几个写几个,多写或写错0分)。
A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(3) 常温下,将铁棒置于浓硫酸中.无明显现象,课本上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面 ,则发生了钝化,若铁棒表面________,则铁和浓硫酸未发生反应。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com