
题目列表(包括答案和解析)
(08安徽六校联考)(18分)某同学设计下列装置进行铁和浓H2SO4反应的实验探究,请回答下列问题。
(1)将16克铁粉放入烧瓶中,由分液漏斗放入18mol/L的浓H2SO420mL,结果没有任何反应现象,原因是__随后点燃A处酒精灯,就有气体产生了(2分)
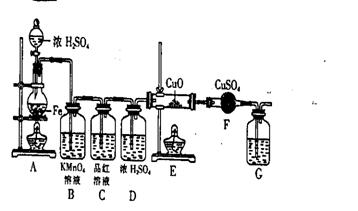 (2)随着反应的进行,B中酸性KMnO4溶液颜色逐渐变浅,请用离子方程式表示_______(3分)C中品红溶液颜色始终没有变化。
(2)随着反应的进行,B中酸性KMnO4溶液颜色逐渐变浅,请用离子方程式表示_______(3分)C中品红溶液颜色始终没有变化。
(3)当G处有持续稳定的气泡时,再点燃E处酒精灯,这样操作的原因是______3分)
(4)反应进行一段时间后,E、F处可观察到明显的现象,其中E中的反应方程式是___(3分),F处可看到的实验现象是___(3分)
(5)为了确保实验的严谨性和F中现象的可信性,G中盛放的液体可以是___________(4分)
A. CaCl2溶液 B. Ca(OH)2溶液 C. 浓硫酸 D. CCl4
(12分)三草酸合铁酸钾晶体K3 [Fe(C2O4 )3]?3H2O可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
限选试剂:浓硫酸、1.0 mol?L-1HNO3、1.0 mol?L-1盐酸、1.0 mol?L-1 NaOH、3% H2O2 、0.1mol?L-1KI、0.1 mol?L-1CuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水。
(1)将气体产物依次通过澄清石灰水(A)、浓硫酸、灼热氧化铜(B)、澄清石灰水(C),观察到A、C中澄清石灰水都变浑浊,B中有红色固体生成,则气体产物是 。
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。验证固体产物中钾元素存在的方法是 ,现象是 。
(3)固体产物中铁元素存在形式的探究。
①提出合理假设
假设1: ; 假设2: ;假设3: 。
②设计实验方案证明你的假设(不要在答题卡上作答)
③实验过程
根据②中方案进行实验。在答题卡上按下表的格式写出实验步骤、预期现象与结论。
实验步骤 | 预期现象与结论 |
步骤1: | |
步骤2: | |
步骤3: | |
…… |
(12分)工业生产无铁硫酸铝,以硫酸浸取铝土矿得含铁(Fe2+和Fe3+)的硫酸铝溶液,加热到一定温度,搅拌,加入一定量高锰酸钾溶液和硫酸锰溶液,在溶液中生成活性二氧化锰,调节溶液的pH,反应一段时间,Fe (OH) 3和二氧化锰发生吸附共沉作用,最终得到无铁硫酸铝产品。
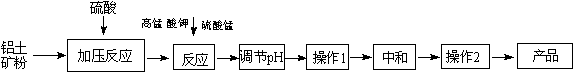
(1)KMnO4首先将Fe2+氧化为Fe3+,其本身被还原为MnO2,反应的离子方程式为 ▲ 。
(2)写出高锰酸钾溶液和硫酸锰溶液反应的化学方程式 ▲ 。实验证明,n(MnO2)/n(Fe)控制在4∶1时,除铁效果较好。若溶液中亚铁离子和铁离子浓度均为0.03 mol/L,为达到较好的除铁效果,每1 L溶液应加入高锰酸钾的物质的量为 ▲ 。
(3)调节pH的作用是 ▲ 。
(4)操作1的名称为 ▲ ,操作2的名称为 ▲ 。
(5)下列有关工艺的说法正确的是 ▲ 。(填字母序号)
A.可以向溶液中再加入铝土矿粉等调节pH
B.溶液的碱性越强,则除铁效果越好,但同时会影响硫酸铝的产率
C.活性二氧化锰生成量应适宜,不足时铁的去除率较低,过量时会增加成本
D.可以直接向溶液中加入二氧化锰粉末以除去Fe (OH) 3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com