
题目列表(包括答案和解析)
(12分)某活动小组探究某无色晶体(纯净物)的组成。先测得相对分子质量为126;经元素分析可知:只含碳、氢、氧三种元素;该无色晶体受热能分解。然后设计了下列实验方案再对其进行定量分析:
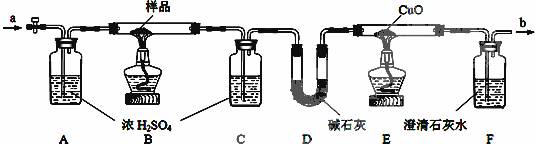
【实验操作】(1)检查装置的气密性;
(2)在相应的仪器中放入相应的试剂,并称量C、D、E的质量;
(3)先从a处通入足量的N2,排尽装置中的空气;
(4)点燃B、E两处的酒精灯,缓缓加热样品,使之发生分解反应;
(5)当样品完全分解后,先熄灭B处的酒精灯,从a处缓缓通入足量的N2,再熄灭E处酒精灯;
(6)冷至室温,拆下各仪器,并称量C、D、E的质量。
【实验现象】 ① E处有红色物质生成,F处有白色沉淀生成;
② 由于实验条件控制得好,b处无可燃性气体放出。
请回答下列问题:
(1)用最简便的方法检查整套装置的气密性:
。
(2)仪器A的作用是 。
(3)操作(3)和(5)若是通入空气,其后果是
。
(4)数据处理:
① 实验记录的数据(各仪器中的吸收或反应都很完全):
| 样品的质量 | C装置增重 | D装置增重 | E装置减轻 |
| 12.6 g | 5.4 g | 4.4 g | 1.6 g |
② 计算判断:样品(无色晶体)的分子式为______________________。
已知:碱金属或碱土金属(ⅡA)与H2在隔绝空气加热时可以发生反应,生成离子型金属氢化物,如NaH、CaH2等,它们易与水反应。现有甲、乙两位同学分别设计了制备纯净CaH2的实验,装置如图所示(分别以序号I、II表示),铁架台等夹持固定仪器已略去(H2的稳定性强于HCl)。
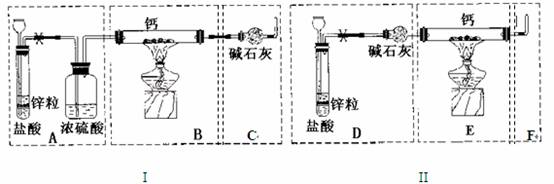
请回答下列问题
(1)锌与盐酸反应的离子方程式为 ;
(2)最后实验结果显示,两位同学的实验装置设计都有缺陷。
装置I的不足之处是 ,
装置II的不足之处是 ;
(3)请你从两套装置中选取你认为合理的部分,按从左到右的顺序组装一套制取CaH2的合理装置(用序号A、B、C……表示) ;
(4)检查完装置的气密性后,为了保证产品的纯度和实验安全必须先 ,然后再 ,才能点燃酒精灯加热。
(5)军事和气象野外作业常用CaH2做生氢剂,使之与水反应产生H2,其反应的化学方程式为 ,该反应中的氧化剂是_______。
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
(8分)测定有机物中碳和氢的质量分数,常用燃烧分析法,用氧化铜为催化剂,在750℃左右使有机物在氧气流中全部氧化成CO2和H2O;分别用装有固体NaOH和Mg(ClO4)2的吸收管吸收CO2和H2O。某课外活动小组,设计利用下图所示装置制取纯净干燥的乙烯,并测定乙烯分子中碳、氢原子的个数比;甲为燃烧管,当乙烯和氧气通过时,由于催化剂的存在而不会发生爆炸,乙烯被氧化成CO2和H2O。请回答下列问题:
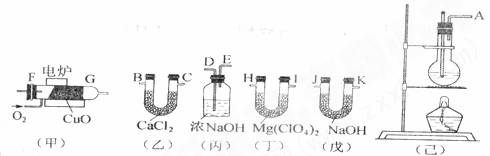
(1)整套装置的连接顺序(按气流方向从左到右填写仪器的接口字母):
(不考虑吸收空气的CO2或H2O)
A接▲ , _▲_接___▲___,_▲____接 ▲ , ▲ 接▲ , ▲ 接J…
(2)烧瓶中的试剂是浓硫酸和酒精,浓硫酸的作用是: ▲ ;
(3)实验时应使烧瓶中溶液的温度迅速升至170℃,原因是 ▲ ;
(4)乙装置的作用是 ▲ ,丙装置的作用是 ▲ ;
(5)若实验前后,丁增重ag、戊增重bg,则测得乙烯分子中C、H原子的个数比为
▲ ;
(6)若测得的比值偏高,导致这种误差的可能的原因是 ▲ ;
A.乙烯中混有少量的CO B.乙烯进入燃烧管时,含有少量的水蒸气
C.乙烯中混有少量的乙醚(C2H5OC2H5) D.乙烯进入燃烧管时,含有少量的CO2
(7)若仍用此装置测定某烃A的化学式。经测定:丁增重4.5g、戊增重8.8g,
则A的分子式为 ▲ ;

| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com