
题目列表(包括答案和解析)
| A.锌是负极、铜是正极 |
| B.电子从铜片经导线流向锌片 |
| C.负极的反应式为2H++2e-=H2↑ |
| D.反应一段时间后,溶液的pH升高 |
下列关于锌、铜和稀硫酸构成的原电池的说法中,正确的是( )
| A.锌是负极、铜是正极 |
| B.电子从铜片经导线流向锌片 |
| C.负极的反应式为2H++2e-=H2↑ |
| D.反应一段时间后,溶液的pH升高 |
高铁电池是电动汽车首选的电池之一,该电池的工作原理为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列关于该电池放电时的说法中正确的是 ( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列关于该电池放电时的说法中正确的是 ( )
| A.高铁电池产生的电流从负极经外电路到达正极 |
| B.正极反应式为Zn+2OH-—2e - =Zn(OH)2 |
| C.负极pH减小,正极pH增大,电解液pH增大 |
| D.每氧化1mol高铁酸钾转移3mol电子 |
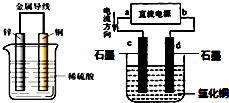
 关于铜锌原电池和电解CuCl2溶液的装置(如图),下列说法正确的是( )
关于铜锌原电池和电解CuCl2溶液的装置(如图),下列说法正确的是( )| A.锌是负极,铜片上有气泡产生,电流从锌片经导线流向铜片 |
| B.铜片质量逐渐减少,氢离子在铜片表面被还原 |
| C.d为阳极,电极反应为:2Cl--2e-=Cl2↑ |
| D.电解过程中,d电极质量增加 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com