
题目列表(包括答案和解析)
已知2KCl(固体)+H2SO4(浓)![]() K2SO4+2HCl↑,则实验室用该原理制取HCl的发生装置与实验室制 氯气 (填气体名称)相同,将制和HCl气体溶于水即得盐酸,吸收时用倒置的漏斗。现用实验室 O2(以KClO3为原料,MnO2作催化剂)的残渣为原料,先制得HCl,再制取Cl2。
K2SO4+2HCl↑,则实验室用该原理制取HCl的发生装置与实验室制 氯气 (填气体名称)相同,将制和HCl气体溶于水即得盐酸,吸收时用倒置的漏斗。现用实验室 O2(以KClO3为原料,MnO2作催化剂)的残渣为原料,先制得HCl,再制取Cl2。
(1)某学生提出的实验步骤依次是:溶解、蒸发、结晶、制气体。其中还缺少的必要步骤是 ;
(2)某学生开列的实验用品为:烧杯、圆底烧瓶、蒸发皿、量筒、集气瓶、分液漏斗、酒精灯、药匙、托盘天平、铁架台(含铁夹、铁圈)、双孔橡皮塞、玻璃导管、橡皮管、火柴、蒸馏水。所缺少的必要试剂是 ,还缺少的必要的实验用品是 。
(3)写出制得的HCl溶液与MnO2反应制Cl2的离子方程式: 。
(4)甲同学用51.33 g的MnO2和足量浓盐酸共热制取Cl2的质量为m g。乙同学用200 mL 36.5%的浓盐酸(ρ=1.18 g/cm3)和足量的MnO2共热制取Cl2,得到Cl2的质量为n g。砂考虑反应物的损耗的前提下,m与n的大小关系是m n(填>、<、=)。
(5)多余的Cl2吸收的装置中所用的仪器是 ,试剂是 (选填序号:A. NaOH饱和溶液,B. Ca(OH)2饱和溶液),你选择的理由是 。
晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅。
![]() ②粗硅与干燥HCl气体反应制得SiHCl3: Si + 3HCl SiHCl3 + H2
②粗硅与干燥HCl气体反应制得SiHCl3: Si + 3HCl SiHCl3 + H2
③ SiHCl3与过量H2在1000~1100℃反应制得纯硅。
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为 。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量
SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为:
。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
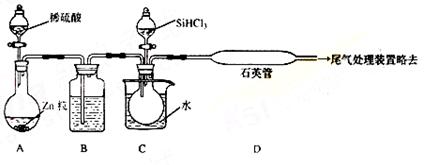
①装置B中的试剂是 ,装置C中的烧瓶需要加热,
其目的是: 。
②装置D不能采用普通玻璃管的原因是 ,
装置D中发生反应的化学方程式为 。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同。
回答下列问题:
(1)A与E形成的化合物的化学式是 。
(2)B的最高价氧化物化学式为 ,
C在周期表中的位置是 ,C的元素名称为 ,
D的单质与水反应的方程式为 。
(3)向D与E形成的化合物的水溶液中逐渐滴入烧碱溶液直至过量,观察到的现象是 ,
有关反应的离子方程式为
。
压强(kPa) 13.33 53.32 101.3
K的沸点(℃) 590 710 770
Na的沸点(℃) 700 830 890
KCl的沸点(℃) 1437
NaCl的沸点(℃) 1465
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为________,而反应的最高温度应低于_______
(2)在制取钾的过程中,为了提高原料的转化率可以采取的措施是________。
(2003年上海高考题)钾是一种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:Na(l)+KCl(l)![]() NaCl(l)+K(g)(正反应为吸热反应),各物质的沸点与压强的关系见下表。
NaCl(l)+K(g)(正反应为吸热反应),各物质的沸点与压强的关系见下表。
压强(kPa) 13.33 53.32 101.3
K的沸点(℃) 590 710 770
Na的沸点(℃) 700 830 890
KCl的沸点(℃) 1437
NaCl的沸点(℃) 1465
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为________,而反应的最高温度应低于_______
(2)在制取钾的过程中,为了提高原料的转化率可以采取的措施是________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com