
题目列表(包括答案和解析)
已知高温下能发生如下反应SiO2+2C Si+2CO,Si+C
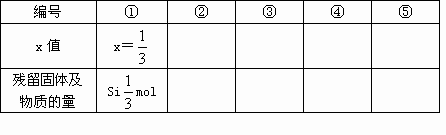
Si+2CO,Si+C SiC,现有石英砂和碳粉的混合物1mol,在高温电炉中隔绝空气充分反应,反应完全后,冷却得到残留固体.若石英砂与混合物的物质的量之比为x(0<x<1)试讨论x的取值范围,残留固体的成分和物质的量,并将结果填入下表:
SiC,现有石英砂和碳粉的混合物1mol,在高温电炉中隔绝空气充分反应,反应完全后,冷却得到残留固体.若石英砂与混合物的物质的量之比为x(0<x<1)试讨论x的取值范围,残留固体的成分和物质的量,并将结果填入下表:
SiO2+2C![]() Si+2CO SiO2+3C
Si+2CO SiO2+3C![]() SiC+2CO
SiC+2CO
现有
(1)原混合物中二氧化硅的质量分数为多少?
(2)完全参加反应的炭的质量的可能范围怎样?
已知二氧化硅与C在高温下有发生两种反应的可能:SiO2+2C![]() Si+2CO↑,SiO2+3C
Si+2CO↑,SiO2+3C![]() SiC+2CO↑.
SiC+2CO↑.
取某石英样品(杂质高温下不与C反应)4.00 g,与足量的C混合共热,把生成的气体完全燃烧后全部通入含Ca(OH)24.44 g的饱和石灰水中,恰好使生成的沉淀又重新溶解.试求:
(1)原样品中SiO2的质量分数是多少?
(2)如有5.00 t这种样品,理论上最多可制得99.9%的高纯硅多少吨?
 晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下: Si+2CO↑.
Si+2CO↑. SiCl4.
SiCl4. Si+4HCl.
Si+4HCl. Si+2CO↑.
Si+2CO↑. SiCl4.
SiCl4. Si+4HCl.
Si+4HCl.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com