
题目列表(包括答案和解析)
(08海南卷)(10分)现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:
①2Mg+O2![]() 2MgO;②3Mg+N2
2MgO;②3Mg+N2 ![]() Mg3N2;③2Mg+CO2
Mg3N2;③2Mg+CO2![]() 2MgO+C
2MgO+C
④Mg+H2O![]() MgO+H2↑ ⑤Mg3N2 +6H2O
MgO+H2↑ ⑤Mg3N2 +6H2O ![]() 3Mg(OH)2+2NH3↑
3Mg(OH)2+2NH3↑
可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)

回答下列问题;
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别______________________________________;
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是 (填字母代号)_________;
(3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响?__________,原因是____________________;
(4)请设计一个实验,验证产物是氮化镁。
(10分)近年来,国际原油价格大幅上涨,促使各国政府加大生物能源生产,其中酒精汽油已进入实用化阶段。
(1)乙醇在铜或银作催化剂的条件下,可以被空气中的氧气氧化成X,X可发生银镜反应,请写出X被银氨溶液氧化的反应方程式(标出具体反应条件):
。
(2)乙醇可以与酸性重铬酸钾溶液反应,被直接氧化成Y,Y含有官能团的名称是________。在浓硫酸存在下加热,乙醇与Y反应可生成一种有香味的物质W,化学方程式为 。
(3)现有两瓶无色液体,分别盛有Y、W,只用一种试剂就可以鉴别,该试剂可以是
(4)现代石油化工采用银作催化剂,乙烯能被氧气氧化生成环氧乙烷( ),该反应的原子利用率为100%,反应的化学方程式为 。
),该反应的原子利用率为100%,反应的化学方程式为 。
(10分,每空1分)某同学在探究废干电池内的黑色固体回收利用时,进行如图示实验:
查阅教材可知,普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质。请回答以下问题:
(1)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、三角架 、 ;
(2)操作④的试管加入③中所得黑色滤渣,试管中迅速产生能使带火星的木条复燃的气
体,据此可初步认定黑色固体为 。
(3)操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测
滤渣中还存在的物质为 。
(4)该同学要对滤液的成分进行检验,以确认是否含有NH4Cl和ZnCl2,下面是他做完实验后所写的实验报告,请你写出其空白处的内容:
| 实验目的 | 操作 | 实验现象 | 结论 |
| 1、检验Cl— | 取少许滤液于试管中,
|
| 含有Cl— |
| 2、检验NH4+ | 取少许滤液于试管中,
|
| 含有NH4+ |
| 3、检验Zn2+ | 取少许滤液于试管中,加入 稀氨水 | 先产生白色沉淀,继续加入氨水,沉淀又溶解 | 含有Zn2+ |
(5)根据以上的实验报告,关于滤液的成分,你的结论是: 。通过一定的操作从滤液中得到固体溶质, 若要将所得固体溶质中的物质加以分离,可用 法。
.(10分)下表是某超市出售的加碘食盐的有关说明:
|
配 料 表 |
精制盐、碘酸钾 |
|
含 碘 量 |
45±5mg/kg |
|
储 藏 方 法 |
通风、防潮 |
|
食 用 方 法 |
根据烹调所需适量加入 |
某研究性学习小组欲通过实验检验该碘盐中是否含碘:
(1)首先取该食盐样品配制室温下的饱和溶液:向200 mL蒸馏水中加入75.0g 该食盐样品,加热并搅拌,直到完全溶解。冷却至室温。(已知室温条件下氯化钠溶解度为36 g)
在加热过程中需要用到的仪器有铁架台、酒精灯、铁圈、____________、烧杯和玻璃棒。冷却至室温过程中若出现____________________(填现象),则证明其为饱和溶液。
(2)甲同学先向该饱和食盐溶液中加入1mol/L的KI溶液和几滴淀粉溶液,然后加入0.1mol/L稀硫酸,振荡,溶液变为蓝色。该实验发生的化学反应中氧化剂与还原剂的物质的量之比为_______________。请在下图中画出参加反应的IO3—的物质的量和析出的I2单质的物质的量的关系曲线。
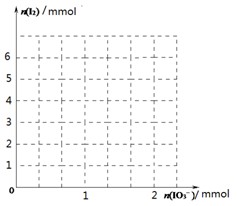
(3)乙同学认为甲同学的实验方案不严谨,他提出如下假设:空气中的氧气可能参与反应,使溶液变蓝。反应的离子方程式为:_____________________________________。请你设计实验方案验证乙同学的假设是否正确: 。
(10分)(1)为了检验和除去下表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内。
|
物质 |
检验试剂 |
除杂试剂 |
|
甲烷(乙烯) |
|
|
|
酒精(水) |
|
|
①检验的试剂:
A.无水硫酸铜 B.酸性高锰酸钾溶液 C.水 D.氢氧化钠溶液
②除杂试剂:
a.无水硫酸铜 b.乙酸 c.新制的生石灰 d.溴水
③写出除杂时,乙烯发生反应的化学方程式:
___________________________________________________________________
(2)如图,在左试管中先加入2 mL 95%的乙醇,并在摇动下缓缓加入3 mL浓硫酸,再加入2 mL乙酸,充分摇匀。按图连接好装置,用酒精灯对左试管小火加热3~5 min后,改用大火加热,当观察到右试管中有明显现象时停止实验。

试回答:
在右试管中通常加入________溶液,实验生成的乙酸乙酯,其密度比水________,是有特殊香味的液体。分离右试管中所得乙酸乙酯的操作为(只填名称)________。反应中加入浓硫酸的作用是________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com