
题目列表(包括答案和解析)
| |||||||||||||||||||||||||
近20年来,对以氢气作为未来的动力燃料氢能源的研究获得了迅速发展.氢是一种需要依靠其他能源如石油、煤、原子能等的能量来制取的所谓“二级能源”,而存在于自然界的可以直接提供现成形式能量的能源称为一级能源,如煤、石油、太阳能等.
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源可持续利用的制氢气的方法是________.
A.电解水
B.锌和稀硫酸反应
C.光解海水
D.以石油、天然气为原料
(2)氢气燃烧时耗氧量小,发热量大.已知,热化学方程式为:
H2(g)+1/2O2(g)![]() H2O(l) ΔH=-285.8 kJ·mol-1
H2O(l) ΔH=-285.8 kJ·mol-1
C(g)+O2(g)![]() CO2(g) ΔH=-393.5 kJ·mol-1
CO2(g) ΔH=-393.5 kJ·mol-1
试通过计算说明等质量的氢气和碳燃烧时产生热量的比是________.
(3)氢能源有可能实现能源的贮存,也有可能实现经济、高效的输送.研究表明过渡金属型氢化物(又称间充氢化物),在这类氢化物中,氢原子填充在金属的晶格间隙之间,其组成不固定,通常是非化学计量的,如:LaH2.76、TiH1.73、CeH2.69、ZrH1.98、PrH2.85、TaH0.78.已知标准状况下,1体积的钯粉大约可吸附896体积的氢气(钯粉的密度为10.64 g/cm3,相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式________.
(1)氢气是一种高效而无污染的理想能源,近20年来,对以氢气作为未来的动力燃料氢能源的研究获得了迅速发展。
① 为了有效发展氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源可持续利用的制氢气的方法是 。
A. 锌和稀硫酸反应 B.光解海水 C.以石油、天然气为原料
② 已知氢气的燃烧热为285.8kJ?mol-1。写出其完全燃烧的热化学方程式 。
(2)有资料报道:Na2FeO4是一种强氧化剂,可作为一种新型净水剂,因此使用该物质可代替Cl2和Al2(SO4)3作为净水剂。
① 配平工业制备铁酸钠的化学方程式:
□Fe2O3+□NaNO3+□NaOH――□Na2FeO4+□NaNO2+□H2O
② 以上反应中,氧化剂为 (填编号)。
a.Fe2O3 b.NaNO3 c.NaOH d.Na2FeO4 e.NaNO2
③ 当反应物中含有1.4molNa+,且上述反应恰好完全进行时,电子转移总数为 NA
科学家认为,氢气是一种高效而无污染的理想能源,近20年来,对氢气作为未来的动力燃料氢能源的研究获得了迅速发展。
(1)已知:2H2(g)+ O2(g)==2H2O(g);△H=-483.6kJ/mol; H2O(g)==H2O(l);△H=-44kJ/mol。
试写出H2燃烧热的热化学方程式:
____________________________________________________________。
(2)某学生查阅大量资料,提出下列“22世纪用水制取氢气的研究方向”。 上述研究方向中,你认为不正确的选项是_________________。
①研究在水不发生化学反应的情况下制取氢气,同时释放能量
②设法将太阳光聚焦,产生高温,使水分解产生氢气
③寻找高效催化剂,大力提高水在一定条件下分解产生氢气的转化率
④寻找特殊化学物质,用于开发廉价能源,以分解水制取氢气
(3)用氢作为能源亟待解决的又一问题是贮氢材料的开发,研究表明某些过渡金属能与氢原子形成氢化物,氢原子填充在金属的晶格间隙之间,其组成不固定,通常是非化学计量的(如LaH2.76)。已知标准状况下,1体积的钯粉大约可吸附896体积的氢气(钯粉的密度为10.64g/cm3),试写出钯(Pd)的氢化物的化学式___________________。
科学家认为,氢气是一种高效而无污染的理想能源,近20年来,对以氢气作为,未来的动力燃料能源的研究获得了迅速发展.
(1)已知: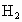 的燃烧热为
的燃烧热为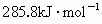 ,试写出
,试写出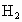 完全燃烧的热化学方程式:_________.
完全燃烧的热化学方程式:_________.
(2)用氢作为能源亟待解决的又一问题是贮氢材料的开发,研究表明某些过渡金属能与氢原子形成氢化物,氢原子填充在金属的晶格间隙之间,其组成不固定,通常是非化学计量的(如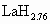 ).已知标准状况下,1体积的钯粉大约可吸附896体积的氢气(钯粉的密度为
).已知标准状况下,1体积的钯粉大约可吸附896体积的氢气(钯粉的密度为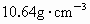 ),试写出钯(Pd)的氢化物的化学式______________.
),试写出钯(Pd)的氢化物的化学式______________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com