
题目列表(包括答案和解析)



某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室中用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
(1)向锥形瓶中移取一定体积的白醋所用的仪器是________,该实验最佳应选用
________作指示剂,达到滴定终点的实验现象是:________.
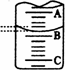
(2)下图表示50 mL滴定管中液面的位置,若A与C刻度间相差1 mL,A处的刻度为25,滴定管中液面读数应为________mL,此时滴定管中液体的体积________.
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
![]()
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是________.
A.实验结束时俯视滴定管中液面,读取滴定终点时NaOH溶液的体积
B.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):C=________.
| 滴定次数 | 待测盐酸的体积(mL) | 标准NaOH溶液体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 20.00 | 0.40 | 20.50 |
| 第二次 | 20.00 | 4.10 | 24.00 |
| 第三次 | 20.00 | 1.00 | 24.00 |

某校课外实验小组同学设计下图装置进行实验。(夹持装置已略去)。
(1)该小组同学用如图装置进行“乙炔的制取及燃烧性质验证”实验。
①制取乙炔的化学方程式是 。
②点燃乙炔前,需要 。
③在导管口c处点燃乙炔,观察到的现象是 ;
(2)该小组同学用上图装置进行实验,确定某饱和醇的结构。
①反应前,先对量气管进行第一次读数。反应后,待装置温度冷却到室温,再对量气管进行第二次读数。读数时,应注意的操作是: ,并使视线与凹液面最低处相平。
②实验数据记录如下:(表中读数已折合成标准状况下的数值)
| | 饱和醇的质量 | 金属钠的质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 0.62 g | 5 .0g(足量) | 40 mL | 264 mL |
| ② | 0.31 g | 2.5 g(足量) | 40 mL | 152mL |

①配制浓度均为1 mol·L-1的盐酸和醋酸溶液;
②在广口瓶乙中装水,按图示连接好装置,检查装置的气密性;
③量取10.00 mL 1 mol·L-1的盐酸和醋酸溶液分别加入两套装置的锥形瓶中;
④称取两份质量均为a g的镁条(除去表面氧化膜、表面积相同),并固定于塑料杆末端;
⑤同时将塑料杆向下移动,使镁条浸入酸中至反应完全;
⑥反应结束后待温度恢复到室温,读出量筒中水的体积为V mL。
请根据上述步骤回答下列问题:
(1)用文字表述步骤②中检查该装置气密性的方法:_____________________。
(2)量取10.00 mL1mol·L-1盐酸和醋酸溶液分别注入锥形瓶中时,所用的仪器是_________(填下列各项序号字母)。
A.50 mL量筒 B.10 mL量筒
C.25 mL酸式滴定管 D.25 mL碱式滴定管
(3)步骤④中,理论上称取的镁条质量不能少于_________ g。
(4)步骤⑤中需记录的数据是_______;实验过程中观察到的主要现象是______________。
(5)步骤⑥中,读取量筒中水的体积时若俯视读数,对计算该条件下的气体摩尔体积影响为_________(填“偏大”“偏小”或“无法确定”)。
(6)为保证实验顺利进行,仪器丙应选用的规格是_________(填序号字母)。
A.100 mL B.200 mL C.500 mL
(7)若水蒸气的挥发影响忽略不计,在该温度和压强下,气体摩尔体积为______ L·mol-1。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com