科研人员将软锰矿(MnO
2含量≥65%,SiO
2含量约20%,A1
2O
3含量约4%,其余为水分)和闪锌矿(ZnS含量≥80%,FeS、CuS、SiO
2含量约7%,其余为水分)同槽酸浸开发出综合利用这两种资源的新工艺,如图所示为工艺流程的一部分.
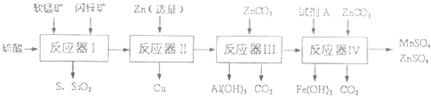
已知:ZnCO
3不溶于水,但溶于酸.部分阳离子以氢氧化物形式深沉时溶液的pH见下表:
| 物质 |
Fe(OH)3 |
A1(OH)3 |
Zn(OH)2 |
Fe(OH)2 |
Mn(OH)2 |
| 开始沉淀pH |
2.7 |
3.3 |
5.4 |
7.6 |
8.3 |
| 完全沉淀pH |
4.4 |
5.2 |
8.0 |
9.6 |
9.8 |
请回答:
(1)反应器I过滤所得滤液中含有MnSO
4、ZnSO
4、CuSO
4、Fe
2(SO
4)
3、A1
2(CO
4)
3等.试完成反应器I中生成CuSO
4的化学方程式(不须配平):CuS+
MnO2
MnO2
+H
2SO
4→
S↓
S↓
+
MnSO4
MnSO4
+CuSO
4+H
2O
(2)反应器II中发生反应的离子方程式为
Zn+2Fe3+=2Fe2++Zn2+、Zn+Cu2+=Cu+Zn2+
Zn+2Fe3+=2Fe2++Zn2+、Zn+Cu2+=Cu+Zn2+
.
(3)从沉淀溶解平衡的角度分析反应器III中生成A1(OH)
3沉淀的原因
ZnCO3与溶液中的H+反应,导致溶液中c(H+)减小,c(OH-)增大,c(Al3+)?c(OH-)>Ksp[Al(OH)3],
ZnCO3与溶液中的H+反应,导致溶液中c(H+)减小,c(OH-)增大,c(Al3+)?c(OH-)>Ksp[Al(OH)3],
.检验ZnCO
3是否过量的操作方法是
取少许沉淀于试管中,滴加适量的稀硫酸,若有气泡产生,则说明ZnCO3过量;若无气泡产生,则说明ZnCO3不过量
取少许沉淀于试管中,滴加适量的稀硫酸,若有气泡产生,则说明ZnCO3过量;若无气泡产生,则说明ZnCO3不过量
.
(4)反应器中IV中,试剂A可以是下列物质中
c
c
(填代号).a.氨水 b.氢氧化钠 c.MnO
2 d.稀硫酸
(5)欲从反应器IV的滤液中完全沉淀出Zn(OH)
2,而不析出Mn(OH)
2,则滤液的pH范围为
8.0≤pH<8.3
8.0≤pH<8.3
,要将分离出沉淀后的滤液进行浓缩,需将温度控制在90℃~100℃,可采用的加热方法是
水浴加热
水浴加热
.

 某同学设计了如图所示装置(部分夹持装置已略去)进行实验研究.请回答:
某同学设计了如图所示装置(部分夹持装置已略去)进行实验研究.请回答:
