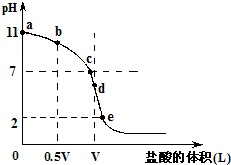
常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题:
(1)氨水的电离方程式为
NH3?H2O?NH4++OH-
NH3?H2O?NH4++OH-
,该温度时氨水的电离平衡常数K=
10-5
10-5
.
(2)比较b、c、d三点时的溶液中,水电离的c(OH
-)大小顺序为
d>c>b
d>c>b
.
(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的有
ACD
ACD
.
A.c(H
+)?c(OH
-) B.
C.
D.
(4)根据以上滴定曲线判断下列说法正确的是(溶液中N元素只存在NH
4+和NH
3.H
2O两种形式)
D
D
.
A.点b所示溶液中:c(NH
4+)+c(H
+)=c(NH
3.H
2O)+c(OH
-)
B.点c所示溶液中:c(Cl
-)=c(NH
3.H
2O)+c(NH
4+)
C.点d所示溶液中:c(Cl
-)>c(H
+)>c(NH
4+)>c(OH
-)
D.滴定中可能有:c(NH
3.H
2O)>c(NH
4+)>c(OH
-)>c(Cl
-)>c(H
+)
(5)滴定过程中所用盐酸的pH=
1
1
,d点之后若继续加入盐酸至图象中的e点(此时不考虑NH
4+水解的影响),则e点对应的横坐标为
.

 常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题:
常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题: