
题目列表(包括答案和解析)
(每空2分,共12分)仔细阅读下列三段文字
①由稀有气体元素Xe(氙)与氧元素形成的一种共价化合物XeO3极不稳定,易转化为单质而呈强氧化性。将适量的XeO3投入含Mn2+的水溶液中,溶液逐渐变为紫红色且pH不断减小。
② 将0.08mol KMnO4固体(质量为12.64g)加热一段时间后,收集到a molO2;
向反应后残留的固体中加入足量的浓盐酸,又收集到b molCl2,此时Mn元素全部以Mn2+的形式存在于溶液中。
③氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式: Cl2+2e- =2Cl-
回答问题:
(1)试写出①有关的离子方程式:_________ _______。
(2)请配平②的化学方程式:
KMnO4+ HCl - KCl+ MnCl2+ Cl2↑+ H2O
通过对第②段文字中提供的数据进行推导和计算可得出:
a +b的最大值为 ,a +b最小值为 。
(3)下列四种物质中能使③中的还原过程发生的物质是 。
A. Na2CO3 B. KMnO4 C. XeO3 D. Na2SO3
将该反应的氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥表示电子转移的方向和数目:

(每一小空2分共12分)下面是一个合成反应的流程图: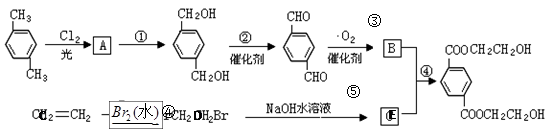
(1)、写出下列物质的结构简式
| A.、 | B.、 |
| C.、 | D. . |
(12分)硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,分别采用以下方案:
【甲方案】:如右图所示,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。
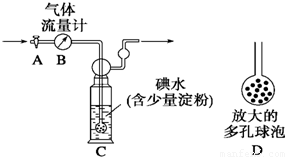
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是_______________________________________。
(2)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量____________(填“偏高”、“偏低”或“无影响”)。
【乙方案】:实验步骤如下面流程图所示:
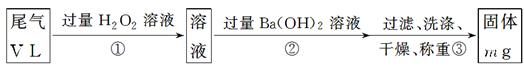
(3)步骤①中过量H2O2的作用是
(4)写出步骤②中反应的化学方程式___________________________________
(5)步骤②中Ba(OH)2是否足量的判断方法是 .
_________________________________。
(6)通过的尾气体积为V L(已换算成标准状况)时,该尾气中二氧化硫的含量(体积分数)为_____________________________(用含有V、m的代数式表示)。
(12分) 图表法、图象法是常用的科学研究方法。请回答以下问题
(1)第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。

① 将Na—Ar之间六种元素用短线连接起来(不必写在答题卷上),构成完整的图像。从上图分析可知,同一主族元素原子的第一电离能I1变化规律是;__________________
_________________________________________________________________________
②上图折线中数字5代表元素在周期表中的位置是___________________________;
(2)已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的X的数值:试结合元素周期律知识完成下列问题:
|
元素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
|
X的数值 |
1.5 |
2.0 |
1.5 |
2.5 |
2.8 |
4.0 |
1.0 |
|
元素 |
Mg |
Na |
O |
P |
S |
Si |
|
|
X的数值 |
1.2 |
0.9 |
3.5 |
2.1 |
2.5 |
1.7 |
|
①经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中的化学键类型是____________________(填离子键或共价键)。
②某有机化合物分子中含有S—N键,你认为该共用电子对偏向于____________原子(填元素符号)。
(3) 已知:波长为300nm的紫外光的光子所具有的能量约为399 kJ/mol。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因: _______________________________________________________________。

(12分)(1)5molCO2的质量是_________;在标准状况下所占的体积约为_________;所含的分子数目约为________________;所含氧原子的数目约为_________________。
(2)12.4gNa2X中含有0.4molNa+,则Na2X的摩尔质量是________,X的相对原子质量是________,该物质的化学式为________。
(3)有下列7种物质:Na2SO4、Na2SO3、K2SO4、I2、H2SO4、KIO3 、H2O组成一个氧化还原反应,请回答下列问题:
①将余下几种物质分别填入下面对应的横线上,组成一个未配平的化学方程式:
________+Na2SO3+________→ Na2SO4 +________+________+H2O
②反应物中发生氧化反应的物质是_________(填化学式),被还原的元素是_______。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com