
题目列表(包括答案和解析)
| 实验方案 | 实验现象 |
| ①用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞 | (A)浮于水面,熔成一个小球,在水面上无定向移动,随之消失,溶液变红色 |
| ②向新制的H2S饱和溶液中滴加新制的氯水 | (B)产生气体,可在空气中燃烧,溶液变成浅红色 |
| ③钠与滴有酚酞试液的冷水反应 | (C)反应不十分强烈,产生无色气体 |
| ④镁带与2mol?L-1的盐酸反应 | (D)剧烈反应,产生无色气体 |
| ⑤铝条与2mol?L-1的盐酸反应 | (E)生成白色胶状沉淀,既而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | (F)生成淡黄色沉淀 |
| 实验方案 | 实验现象(填写序号) |
| ① | B B |
| ② | F F |
| ③ | A A |
| ④ | D D |
| ⑤ | C C |
| ⑥ | E E |
(14分)某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。
|
实验方案 |
实验现象 |
|
①用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞 |
A.浮于水面,熔成小球,在水面上无定向移动,随之消失,溶液变成红色 |
|
②向新制的H2S饱和溶液中滴加新制的氯水 |
B.产生大量气体,可在空气中燃烧,溶液变成浅红色 |
|
③钠与滴有酚酞试液的冷水反应 |
C.反应不十分强烈,产生的气体可以在空气中燃烧 |
|
④镁带与2mol·L-1的盐酸反应 |
D.剧烈反应,产生的气体可以在空气中燃烧 |
|
⑤铝条与2mol·L-1的盐酸反应 |
E.生成白色胶状沉淀,继而沉淀消失 |
|
⑥向氯化铝溶液中滴加氢氧化钠溶液 |
F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:______________________________________________________。
(2)实验用品。仪器___________________等;药品________________________等。
(3)实验内容:(*填写题给信息表中的序号)
|
实验方案* |
实验现象* |
有关化学方程式 |
|
|
|
|
|
|
|
|
(4)实验结论:________________________________________________________。
(5)请从结构理论上简单说明具有上述结论的原因 。
(6)请你补充一组实验方案(简单易行),证明此周期中另外两种元素的性质递变规律 。
(14分)某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。
| 实验方案 | 实验现象 |
| ①用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞 | A.浮于水面,熔成小球,在水面上无定向移动,随之消失,溶液变成红色 |
| ②向新制的H2S饱和溶液中滴加新制的氯水 | B.产生大量气体,可在空气中燃烧,溶液变成浅红色 |
| ③钠与滴有酚酞试液的冷水反应 | C.反应不十分强烈,产生的气体可以在空气中燃烧 |
| ④镁带与2mol·L-1的盐酸反应 | D.剧烈反应,产生的气体可以在空气中燃烧 |
| ⑤铝条与2mol·L-1的盐酸反应 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向氯化铝溶液中滴加氢氧化钠溶液 | F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:______________________________________________________。
(2)实验用品。仪器___________________等;药品________________________等。
(3)实验内容:(*填写题给信息表中的序号)
| 实验方案* | 实验现象* | 有关化学方程式 |
|
|
|
|
|
|
|
|
(4)实验结论:________________________________________________________。
(5)请从结构理论上简单说明具有上述结论的原因 。
(6)请你补充一组实验方案(简单易行),证明此周期中另外两种元素的性质递变规律 。
| 实验方案 | 实验现象 |
| 1.用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞 2.向新制的H2S饱和溶液中滴加新制的氯水 3.钠与滴有酚酞试液的冷水反应 4.镁带与2mol/L的盐酸反应 5.铝条与2mol/L的盐酸反应 6.向AlCl3溶液中滴加NaOH溶液至过量 |
A.浮于水面,熔成小球,四处游动,逐渐缩小,溶液变红色 B.产生大量气体,气体可燃,溶液变浅红色 C.反应不十分强烈,产生的气体可燃 D.剧烈反应,产生的气体可燃 E.生成白色絮状沉淀,继而沉淀消失 F.生成淡黄色沉淀 |
| 实验方案 | 实验现象 | 有关离子方程式 |
| A | ||
| B | 不 填 | |
| 不 填 | ||
| 不 填 | ||
| E | ||
| F |
T℃时,有甲、乙两个密闭容器,甲容器的体积为1 L,乙容器的体积为2 L,分别向甲、乙两容器中加入6 mol A和3 mol B,发生反应如下:3A(g)+bB(g) 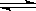 3C(g)+2D(g) ΔH<0; 4 min时甲容器内的反应恰好达到平衡,A的浓度为2.4 mol/L,B的浓度为1.8 mol/L; t min时乙容器内的反应达平衡,B的浓度为0.8 mol/L.根据题给信息回答下列问题:
3C(g)+2D(g) ΔH<0; 4 min时甲容器内的反应恰好达到平衡,A的浓度为2.4 mol/L,B的浓度为1.8 mol/L; t min时乙容器内的反应达平衡,B的浓度为0.8 mol/L.根据题给信息回答下列问题:
(1)甲容器中反应的平均速率v(B)=________,化学方程式中计量数b=________.
(2)乙容器中反应达到平衡时所需时间t________4 min(填“大于”、“小于”或“等于”),原因是______________________________.
(3)T℃时,在另一个体积与乙相同的丙容器中,为了达到平衡时B的浓度仍然为0.8 mol/L,起始时,向丙容器中加入C、D的物质的量分别为3 mol、2 mol,则还需加入A、B的物质的量分别是________、________.
(4)若要使甲、乙容器中B的平衡浓度相等,可以采取的措施是________.
A.保持温度不变,增大甲容器的体积至2 L
B.保持容器体积不变,使甲容器升高温度
C.保持容器压强和温度都不变,向甲中加入一定量的A气体
D.保持容器压强和温度都不变,向甲中加入一定量的B气体
(5)写出平衡常数表达式K=________,并计算在T℃时的化学平衡常数K=________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com