
题目列表(包括答案和解析)
| O | 2- 7 |
| O | 2- 4 |
| O | 2- 7 |

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 |
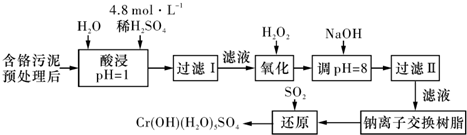
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | - | _ | 4.7 | - |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
| O | 2- 7 |
| O | 2- 4 |
| O | 2- 7 |
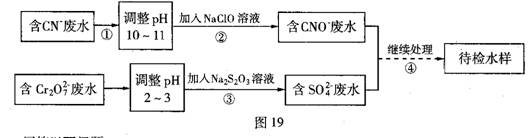
某电镀铜厂有两种废水需要处理,一种废水中含有CN—离子,另一种废水中含有Cr2O2-7离子。该厂拟定如图19所示的废水处理流程。
回答以下问题:
(1)上述处理废水的流程中主要使用的方法是 。
(2)②中使用的NaCl0溶液呈碱性,用离子方程式解释原因____。
(3)②中反应后无气体放出,该反应的离子方程式为 。
(4)③中反应时,每0.4 mol Cr2O2-7转移2.4 mol e-,该反应的离子方程式为 。
(5)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少。请你使用化学用语,结合必要的文字解释其原因 。
在中学化学中铁及其化合物应用广泛,用所学知识回答下列问题。
(1)将一定量的铁粉在氯气中燃烧后所得固体溶于水可得到溶液X。取少量X溶液两份,一份加入KSCN溶液时,溶液显红色;另一份中加入酸性KMnO4溶液时,KMnO4溶液紫色褪去。试分析:
①溶液X含有的金属阳离子应该是 。
②用化学方程式表示上述金属阳离子产生的原因 。
③酸性KMn04溶液紫色褪去的离子方程式为 。
(2)含铬化合物有毒,通常是将废水中+6价铬(如Cr2O2—7)用还原剂还原成Cr3+,再调节溶液pH使Cr3+转化为Cr(OH)3沉淀而除去。工业上有一种电解除Cr2O2—7的方法:将含K2Cr2O7的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。
试分析该电解除Cr2O2—7的方法中:
①阴极的电极反应式为 ;
②电解时加入氯化钠的作用是 ;
③该方法能除去Cr2O2—7的原理是 。
某电镀铜厂有两种废水需要处理,一种废水中含有CN—离子,另一种废水中含有Cr2O2-7离子。该厂拟定如图19所示的废水处理流程。
回答以下问题:
(1)上述处理废水的流程中主要使用的方法是 。
(2)②中使用的NaCl0溶液呈碱性,用离子方程式解释原因____。
(3)②中反应后无气体放出,该反应的离子方程式为 。
(4)③中反应时,每0.4 mol Cr2O2-7转移2.4 mol e-,该反应的离子方程式为 。
(5)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少。请你使用化学用语,结合必要的文字解释其原因 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com