
题目列表(包括答案和解析)


Si+4HF══SiF4↑+2H2↑
Si+2NaOH+H2O══Na2SiO3+2H2↑
又知硅及其化合物间存在如下图所示的关系:
其中A是制造芯片和光电池的主要原料;B是含硅化合物中的一种气体;某些C可作干燥剂或催化剂的载体;D是一种黏合剂,能将磨砂玻璃黏合在一起;E是一种比H2CO3酸性还弱的酸。
试回答下列问题:
(1)写出A、C、E的化学式:A________、C________、E________。
(2)①~⑦反应中,属于氧化还原反应的是________,属于置换反应的是________,属于离子反应的是________。
(1)Ge的原子结构示意图:____________;
(2)按要求指出下列氧化物的空间构型、成键方式(化学键类型)或性质
①CO2分子的空间构型____________;
②SiO2晶体中硅氧原子之间的成键方式____________;
③已知SnO2是离子晶体,写出其主要物理性质______________________(写出2条即可)。
已知Si能与HF(aq)和NaOH(aq)反应:Si+4HF══SiF4↑+2H2↑ Si+2NaOH+H2O══Na2SiO3+2H2↑,又知硅及其化合物间存在如下图所示的关系:
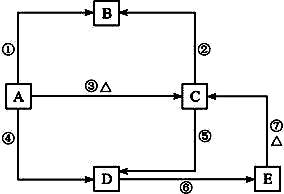
其中A是制造芯片和光电池的主要原料;B是含硅化合物中的一种气体;某些C可作干燥剂或催化剂的载体;D是一种黏合剂,能将磨砂玻璃黏合在一起;E是一种比H2CO3酸性还弱的酸。
试回答下列问题:
(1)写出A、C、E的化学式:A________、C________、E________。
(2)①~⑦反应中,属于氧化还原反应的是________,属于置换反应的是________,属于离子反应的是________。
C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用.请回答下列问题:
(1)32号元素Ge的原子核外电子排布式为 ;
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是 ;
(3)已知SnO2是离子晶体,写出其主要物理性质 ;(写出2条即可)
(4)已知:
| | CH4 | SiH4 | NH3 | PH3 |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com