
题目列表(包括答案和解析)
(8分)从短周期元素中找出满足下列条件的单质或化合物:
⑴跟水反应最剧烈的金属元素的单质是 ;跟水反应最剧烈的非金属元素的单质是 ;常温下有颜色的气体单质是 。
⑵含氢质量分数最大的气态氢化物是 ;水溶液对玻璃有强烈腐蚀性的气态氢化物是 ;四核10电子粒子有 。
(本题共8分)在玻璃生产中,熔炉里原料发生的主要反应为:
2Na2CO3+CaCO3+3SiO2 2Na2SiO3+CaSiO3+3CO2↑
2Na2SiO3+CaSiO3+3CO2↑
(1).某反应物在熔融状态下不导电,它属于_____晶体。
(2).上述反应里,在周期表中相邻两元素的原子半径______>______(填元素符号) ,处于同一周期元素的名称是__________________。
(3).上述反应里金属性最强的短周期元素,其原子核外有______种不同能级的电子,其单质在O2中充分燃烧, 产物的电子式为_____________。
(4).H2与O2发生反应的过程用模型图示如下(“—”表示化学键):

其中过程Ⅰ是______过程(填“吸热”、“放热”或“没有能量变化”)。图④中产生了由极性键构成的__________分子(填“极性”或“非极性”)。
(8分)有一瓶澄清溶液,可能含有 、
、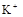 、
、 、
、 、
、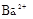 、
、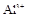 、、
、、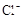 、
、 、
、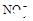 、
、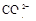 、
、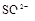 中的一种或几种。取该溶液进行以下实验:
中的一种或几种。取该溶液进行以下实验:
①用pH试纸检验,表明溶液呈强酸性;
②取出部分溶液,加入少量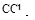 及数滴新制氯水,经振荡
及数滴新制氯水,经振荡 层呈紫红色;
层呈紫红色;
③另取部分溶液,向其中逐滴加入NaOH溶液,使溶液从酸性变为碱性,在滴加过程中先生成白色沉淀后完全溶解;取部分碱性溶液加热,有气体放出,该气体能使润湿的红色石蕊试纸变蓝。
④另取部分③中的碱性溶液,向其中加入 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。
根据以上实验事实回答下列问题:
(1)该溶液中肯定存在的离子是 ,肯定不存在的离子是 ;
(2)步骤③加入NaOH溶液过程中先生成白色沉淀后完全溶解的离子方程式为 ;
(8分)经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
(1)定性分析:如图甲可通过观察___________________________________定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是____________________,
写出H2O2在二氧化锰作用下发生反应的化学方程式:
_____________________________________________________。
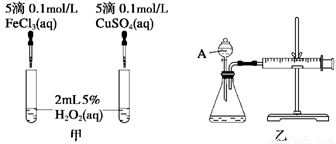
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为________,实验中需要测量的数据是_________________。
(8分)下面是中学化学实验中常见的几种定量仪器:
a、量筒b、容量瓶c、滴定管d、托盘天平e、温度计
(1)其中标示出仪器使用温度的是_____________(填写编号);
(2)实验时用来精确量取液体体积的是__________(填写编号);
(3)使用前要检查仪器是否漏液的是____________________(填写编号);
(4)称取10.5g固体样品(1g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为_______________g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com