
题目列表(包括答案和解析)
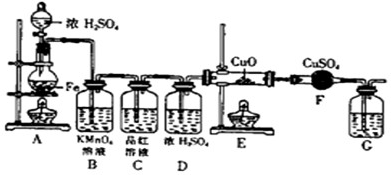
序号 | ① | ② | ③ |
仪器及装置图 |
|
|
|
序号 | ④ | ⑤ | ⑥ |
仪器及装置图 |
|
|
|
(1)如果制取的气体从左向右流时,上述各仪器装置的正确连接顺序是(填各装置的序号):( )接( )接?( )?接( )接( )接( );其中,②与④装置相连时,玻璃管接口应是 接 (用装置中的字母表示)。?
(2)装置②的作用是 ;装置④的作用是 ;装置⑥中发生反应的离子方程式是 。?
(3)实验开始时,应首先检验装置的 ,其方法是 ;实验结束时,应先熄灭 处的酒精灯。?
(4)在装置⑤的烧瓶中,发生反应的化学方程式为 。?
(5)待充分反应后,装置①的玻璃管中剩余物呈 色,冷却后,将制得的产物配成饱和溶液,溶液呈 色。
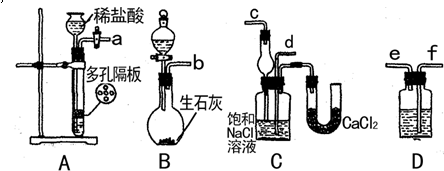
无水氯化铝是白色晶体,露置在空气中极易水解,在178℃升华,装有无水氯化铝试剂瓶露置空气中,会产生大量白雾,氯化铝常作为有机合成和石油工业的催化剂。下图是实验室制取氯气并用于制取少量无水氯化铝的装置的仪器和药品。
可供选用的试剂如下:
A.食盐晶体 B.水 C.饱和食盐水 D.烧碱溶液 E.铝粉
F.二氧化锰 G.浓硫酸 H.无水CaCl2 I.碱石灰

回答下列问题:
(1)从上述仪器中选取若干连成一制备并保存无水AlCl3的装置,用图中各管口标号按先后可连接为:d接e ,( )接( ),( )接( ),( )接( )。
(2)填写连接装置中各选用仪器里应盛放的物质:
| 仪器标号 | (1) | (2)(上) | (2)(下) | (3) | (4) | (5) |
| 试剂标号 | G | A F |
(3)设计使用(5)仪器和药品有两个主要作用是: 和 。(4)在装置(2)中主要发生了两个反应,其中有一个是非氧化还原反应,该反应的化学方
程式是: 。
(5)写出AlCl3露置在空气中生成白雾的化学方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com